
19.(6分)称取纯的NaCl和KCl混合试样0.1200克,溶于水,用0.1000mol∙L-1AgNO3标准溶液滴定(以K2CrO4为指示剂),用去20.00ml,计算试样中NaCl和KCl的百分含量。(已知KSP(AgCl)=1.8×10-10;KSP(Ag2CrO4)=2.0×10-12;Ag2CrO4为黄色沉淀)
18.(6分)已知高锰酸钾、二氧化锰在酸性条件下能将草酸钠(Na2C2O4)氧化:
MnO4- +C2O42- +H+→Mn2++CO2+H2O(未配平)
MnO2+C2O42- +H+→Mn2++CO2+H2O(未配平)
为测定某软锰矿中二氧化锰的质量分数,准确称量1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到容量瓶中用蒸馏水稀释至刻度,从中取出25.0mL,再用0.0200mol·L-1高锰酸钾溶液进行滴定。当加入20.0mL溶液时恰好完全反应,问:
(1)欲求得软锰矿中二氧化锰的质量分数,还缺一个数据,这个数据是
(填数据所代表的意义)。
(2)若该数据的数值为250.0,求该软锰矿中二氧化锰的质量分数。
17.(10分)间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与I-作用定量析出I2,I2溶于过量的KI溶液中:
I2+I- I3-,又知氧化性:Fe3+>Cu2+>I2>FeF63-;析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32-+I2 ==S4O62-+2I-。
I3-,又知氧化性:Fe3+>Cu2+>I2>FeF63-;析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32-+I2 ==S4O62-+2I-。
准确称取ag胆矾试样,置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL3mol/LH2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀。盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去VmL标准液。
①实验中,在加KI前需加入少量NaF,推测其作用可能是 。
②实验中加入,你认为硫酸的作用是 。
③本实验中用碘量瓶而不用普通锥形瓶是因为: 。
④硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为: 。
⑤根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)= 。
16.(8分)双指示剂法可用来测定试样中含有NaOH、NaHCO3和Na2CO3中的一种或两种物质的含量。具体做法是:先向待测溶液中加入酚酞,用标准盐酸滴定。当NaOH或Na2CO3被转化为NaCl或NaHCO3时,酚酞由红色褪为无色,消耗V1ml盐酸,然后滴回甲基橙,继续用标准盐酸滴定。当NaHCO3转化为NaCl时,溶液由黄色变为橙色,消耗V2ml盐酸。
(1)试根据下表给出的V1、V2数据范围,判断原混合物的成分(用化学式表示)。
|
V1和V2 |
V1=0,V2≠0 |
V1≠0,V2=0 |
V1=V2≠0 |
V2>V1>0 |
V1>V2>0 |
|
试样成分 |
|
|
|
|
|
(2)若称取含杂质的试样1.200g(杂质不与HCl反应)配制成100.0ml水溶液,取出20.00ml,用0.1000mol/L标准盐酸滴定,测得V1=35.00ml,V2=5.0ml,求试样的成分及其试样中各成分的质量分数。
15.(6分)用中和滴定方法测定NaOH和Na2CO3混合溶液中两种溶质的物质的量浓度,有以下几种方法:
实验1:①取混合液Vml,加入足量BaCl2溶液后,以酚酞为指示剂用浓度为c1mol/L的标准盐酸滴定,到终点时用盐酸V1mol。②再取混合液Vml,以甲基橙为指示剂,用上述盐酸滴定,到终点时,耗用盐酸V2ml。
实验2:①取混合液Vml,直接以酚酞为指示剂,用浓度为c1mol/L的标准盐酸滴定,到终点时用盐酸V1ml。②再取混合液Vml,以甲基橙为指示剂,用上述盐酸滴定,到终点时耗用盐酸V2ml。
实验3:①取混合液Vml,加入足量BaCl2溶液后,以甲基橙为指示剂,用浓度为c1mol/L的标准盐酸滴定,到终点时用盐酸V2ml。②再取混合液Vml,以酚酞做指示剂,用上述盐酸滴定,到终点时耗用盐酸V2ml。
请回答上述实验方法是否合理;如果合理,请写出计算c(NaOH)、c(Na2CO3) (mol/L)的数学表达式。
14.(10分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol (CH2)6N4H+与1mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:
|
滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 |
1.02 |
21.03 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.1010m01·L-1,则该样品中氮的质量分数为 。
13.(6分)用已知物质的量浓度的盐酸滴定未知物质的量浓度的NaOH溶液(酚酞作指示剂)。下列情况会使测定结果偏高的是 。
①酸式滴定管用水洗后便装液体进行滴定;②碱式滴定管水洗后,就用来量取待测液;
③锥形瓶用蒸馏水洗涤后,又用待测液润洗;④滴定过快成细流、将碱液溅到锥形瓶壁而又未摇匀洗下;⑤盐酸在滴定时溅出锥形瓶外;⑥滴加盐酸,经色不足半分钟即褪色;⑦滴定前,酸式滴定管有气泡,滴定后消失;⑧记录起始体积时,仰视读数,终点时俯视。
12.(4分)某学生中和滴定实验的过程如下:(a)取一支碱式滴定管,(b)用蒸馏水洗净,(c)即加入待测的NaOH溶液,(d)记录液面刻度读数,(e)用酸式滴定管精确放出一定量标准酸液,(f)置于未经标准酸液润洗的洁净的锥形瓶中,(g)加入适量蒸馏水,(h)加入酚酞试液两滴,(i)滴定时,边滴边摇荡,(j)边注视滴定管内液面的变化,(k)当小心滴到溶液由无色变成粉红色时,即停止滴定,(l)记录液面刻度读数,(m)根据滴定管的两次读数得出NaOH溶液体积为22毫升.指出上述实验过程中错误之处(用编号表示) 。
11.(4分)有一支已经洗净并用待测浓度的NaOH溶液润洗过的25mL的碱式滴定管,怎样用它来准确量取25.00mL的待测浓度的NaOH溶液,请简述操作过程。
答:在该碱式滴定管中装满待测浓度的NaOH溶液,把它固定在滴定管夹上,
。
10.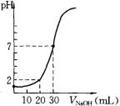 下图为10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液滴定的图示,据图推出NaOH溶液和盐酸的物质量的浓度正确的是
下图为10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液滴定的图示,据图推出NaOH溶液和盐酸的物质量的浓度正确的是
|
|
A |
B |
C |
D |
|
c(HCl)(mol/L) |
0.12 |
0.04 |
0.12 |
0.09 |
|
c(NaOH)(mol/L) |
0.04 |
0.12 |
0.06 |
0.03 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com