
36.(8分)[物理-物理3-3]
(1)下列说法正确的是 (填字母代号)
A.布朗运动是悬浮在水中的花粉颗粒的运动,反映了水分子的永不停息的无规则运动
B.扩散现象证明了物质分子永不停息地做无规则的运动
C.随分子间的距离变大,分子间的引力和斥力都减小,其合力也减小
D.当分子之间的距离为r0,即引力和斥力大小相等时,分子势能最大
E.物体的温度为0℃时,其分子热运动的平均动能为零
F.电冰箱的制冷系统能够不断地把冰箱内的热量传到外界,这违背了热力学第二定律
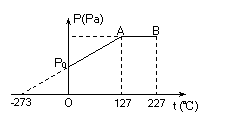 (2)图示为0.2mol某种理想气体的压强与温度关系图线,已知标准大气压P0=1.0×105Pa,则气体在B状态时的压强为
,体积为
.
(2)图示为0.2mol某种理想气体的压强与温度关系图线,已知标准大气压P0=1.0×105Pa,则气体在B状态时的压强为
,体积为
.
35.(8分)[生物----现代生物科技专题]
 下图是利用生物工程技术生产治疗心脏病药物tPA的过程示意图,其中①、②、③、④、⑤表示过程。请据图分析回答:
下图是利用生物工程技术生产治疗心脏病药物tPA的过程示意图,其中①、②、③、④、⑤表示过程。请据图分析回答:
(1)重组tPA基因时,过程①需要用_____________分别切割运载体和目的基因,运载体的黏性末端与目的基因的黏性末端是通过_______________酶结合的。
(2)图中的②过程选择受精卵作为tPA基因受体细胞的主要原因是________________。体外形成羊受精卵必须在______________的作用下排卵,然后进行_________________。
(3)在③过程培养重组细胞时,培养液中通常含有葡萄糖、氨基酸、无机盐、维生素和________________等。
(4)如要通过④过程产生大量基因型相同的克隆羊,则该过程需要采用的技术主要有细胞核移植和________。细胞核移植时,受体细胞要用__________期的卵母细胞。
34.(8分) [生物----生物技术与实践]
酵母菌等微生物在人类的日常生活中发挥着越来越大的作用。请回答下列问题:
(1)利用酵母菌将葡萄汁发酵后是否有酒精产生,可以用重铬酸钾来检验,在酸性条件下,重铬酸钾与酒精反应呈现 色。在发酵过程中, 随着酒精度的提高, 发酵液逐渐呈现深红色, 原因是_____________。
(2)为了提高葡萄酒品质可以在葡萄汁中加入人工培养的酵母菌,可利用 培养基来分离获得较为纯净的酵母菌种。
(3)具有耐高糖和耐酸特性的酵母菌是理想的酒精发酵菌种的原因是 。对野生酵母菌进行诱变可筛选出具有耐高糖和耐酸性的高产突变菌株,利用 技术可大量获得突变菌所携带的特殊基因。
(4)在酵母菌的纯化培养中,培养基上会出现一些分别由一个酵母菌繁殖而成的_______。为了能反复利用,需要将纯化后并经过繁殖培育得到的酵母菌与海藻酸钠溶液混合制成“凝胶珠”,这是使用___________技术来固定酵母细胞。
33.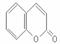 (8分)[化学--有机化学基础]
(8分)[化学--有机化学基础]
下图中X(C7H6O2)与FeCl3溶液作用显紫色,可用于合成香料Y
E、F、G三种物质分子中含有相同的碳原子数,其中E、F均能与银氨溶液作用。
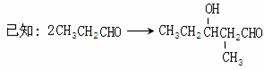
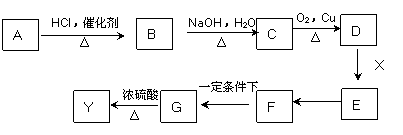
请根据上述信息回答:
(1)A物质的化学式为_________,D中含氧官能团的名称是__________。
(2)E→F的反应类型为___________,F→G的反应类型为___________。
(3)写出X的能使FeCl3溶液显紫色的同分异构体的结构简式___________、__________。
(4)G在浓硫酸存在的条件下加热反应生成Y的化学方程式为_______________________。
32.(8分)[化学--物质结构与性质]
N和B元素在化学中有很重要的地位。
(1)写出与N元素同主族的As元素的基态原子核外电子排布式_____________________。
从原子结构的角度分析B、N和O元素的第一电离能由大到小的顺序为____________。
(2)N元素与B元素的氟化物化学式相似,均为AB3型,但分子的空间结构有很大不同,其原因是_____________________________________________,其中BF3的分子构型为__________。
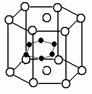 (3)立方氮化硼可利用人工方法在高温高压条件下合成,其硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料。BN的晶体结构与金刚石相似,其中B原子的杂化方式为________,微粒间存在的作用力是________。
(3)立方氮化硼可利用人工方法在高温高压条件下合成,其硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料。BN的晶体结构与金刚石相似,其中B原子的杂化方式为________,微粒间存在的作用力是________。
(4)硼和镁的化合物在超导方面也有应用。右图示意的是该化合物的晶体结构单元;镁原子间形成正六棱柱,且棱柱的上下底的中心各有一个镁原子;六个硼原子位于棱柱内,则该化合物的化学式可表示为______________。
31.(8分)[化学--化学与技术]
将某工业生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,在经济效益、资源综合利用以及环境保护角度都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
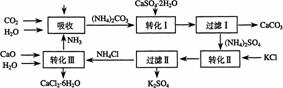
(1)本工艺中所用的原料除CaSO4·2H2O外,还需要的原料有____________(填字母)。
①(NH4)2SO4 ②KCl ③CaCO3 ④NH3 ⑤H2O
(2)过滤Ⅰ操作所得固体中,除CaCO3外还含有__________(填化学式),该固体可用作生产水泥的原料。
(3)写出转化Ⅲ发生反应的化学方程式_______________________________________。
(4)上述工艺流程中体现绿色化学理念的有____________________________________。
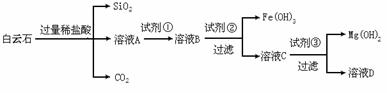
30.(15分)白云石的主要成分为CaCO3·MgCO3,还含有少量Fe、Si的化合物。实验室以白云石为原料制备Mg(OH)2及CaCO3。步骤如下:
实验过程中需要的数据见下表:
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+
|
1.9 |
3.2 |
|
Fe2+ |
7.0 |
9.0 |
|
Mg2+ |
9.5 |
11.0 |
请回答下列问题:
(1)溶液A中含有Ca2+、Mg2+、Fe2+、Fe3+,则试剂①可选择_________(填字母,下同);试剂②可选择_________;试剂③可选择_________。
(A)KMnO4(B)Cl2(C)MgO(D)CaO
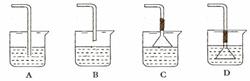
(2)若要利用反应过程中生成的CO2,从溶液D中制取CaCO3,需要先通入的一种气体是_______,然后通入CO2。通入CO2气体应选择的最佳装置为_______(填字母)。
(3)根据表中提供的数据判断,Fe(OH)3、Fe(OH)2和Mg(OH)2的溶度积常数由小到大的排列顺序为________________________________。
(4)将制取的Mg(OH)2煅烧得到MgO,然后在还原炉(真空)中,1200℃条件下,用硅铁(铁不参与反应)还原生成镁蒸气。在还原过程中反应温度对生成金属镁的影响如下图:
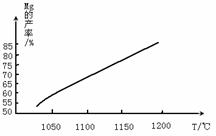
煅烧Mg(OH)2所需要的仪器除三角架、酒精灯外,还必须选择___________。MgO与硅铁发生的反应达到平衡后,平衡常数表达式为_______________________。由图可知,还原反应的△H ____0(填“>”或“<”)。
29.(12分)过氧化氢是一种重要的化工原料,它具有氧化性、还原性、不稳定性和弱酸性。
(1)废旧印刷电路板经粉碎处理,分离得到金属粉末和非金属粉末。控制其他条件相同,将金属粉末用10% H2O2和3.0mol·L-1 H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜的平均溶解速率 (×10-3mol·L-1 ·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是________________________________________________________________。
(2)在酸性条件下,过氧化氢可以氧化Fe2+;过氧化氢也可以被Fe3+氧化。通过改变反应途径,Fe2+和H+实际对H2O2的分解起着催化剂的作用。试用离子方程式表示Fe2+和H+对H2O2分解反应的催化过程________________________________;__________________________。
(3)下列试剂能够证明过氧化氢具有还原性的是________________(填序号)。
①酸性高锰酸钾溶液 ②KI溶液 ③亚硫酸溶液 ④Ba(OH)2溶液
(4)将H2O2溶液逐滴加入含有酚酞的NaOH溶液中,红色消失。甲同学认为是由于H2O2是弱酸性,消耗OH-,而使红色褪去;乙同学认为是由于H2O2具有强氧化性,将酚酞氧化,而使红色褪去。请设计一个实验验证甲、乙同学的解释谁正确,简述实验方案______________________________________________________________________________________________________。
28.(15分)运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是_________(填序号)
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出84消毒液露置在空气中发生反应的离子方程式__________________________
__________________________。
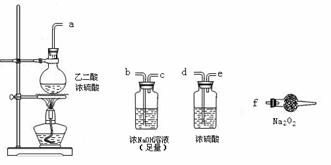
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。
|
已知:H2C2O4====== CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为________;
若CO能够与Na2O2发生反应,则预测反应产物为____________。实验后用球形干燥管中的固体进行验证可选择的试剂是_______________________________。
(4)已知C(s)+O2(g)=CO2(g),△H=-393.5 kJ·mol -1 ;CO(g)+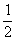 O2(g)=CO2(g),△H=-283.0 kJ·mol -1,写出CO2
和C(s)反应的热化学方程式_____________________________________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
O2(g)=CO2(g),△H=-283.0 kJ·mol -1,写出CO2
和C(s)反应的热化学方程式_____________________________________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
27.(16分)自然界中,多数动物的性别决定属于XY型,而鸡属于ZW型(雄:ZZ,雌:ZW)。鸡具有一些易观察的性状,且不同相对性状之间的差别明显,易于分辨,因此常作为遗传研究的实验材料。下面是一组关于鸡的某些性状的遗传研究,请分析回答:
(1)鸡冠的形状是由位于不同对的常染色体上的两对等位基因A、a和R、r决定,有四种类型,胡桃冠(A_R_)、豌豆冠(A_rr)、玫瑰冠(aaR_)和单冠(aarr)。
①两亲本杂交,子代鸡冠有四种形状,比例为3:3:1:1,且非玫瑰冠鸡占5/8,则两亲本的基因型是____
____________。
②让纯合的豌豆冠鸡和玫瑰冠鸡杂交,子一代的雌雄个体自由交配,F2代与亲本鸡冠形状不同的个体中,杂合体占的比例为_________________。
③某养鸡户的鸡群中没有玫瑰冠个体,而另外三种鸡冠雌雄个体都有,欲通过一代杂交获得尽可能多的玫瑰冠鸡,最好选择基因型为___________________的两种亲本杂交。
(2)鸡的羽毛有芦花和非芦花两种,由另一对染色体上的一对等位基因控制,芦花(B)对非芦花(b)是显性。芦花鸡羽毛在雏鸡阶段的绒羽为黑色且头顶有黄色斑点。若欲确定B、b基因的位置,可选择纯合的芦花雌鸡和非芦花雄鸡杂交。
①若F1代表现型为__________________,则可以肯定B、b基因位于Z染色体的非同源区段(即W染色体上没有与之等位的基因)上。
②若F1代全为芦花鸡,则B、b基因位于______________。若欲再通过一代杂交作进一步的判断,其最简单的方法是_______________。
③假设实验已确定B、b基因位于Z染色体的非同源区段上。现有一蛋用鸡养殖场为了降低饲养成本,提高经济效益,在他们扩大养殖规模时,请你告诉他们-种亲本配种的方法及筛选的措施,以实现他们的愿望。
亲本的基因型:________________。筛选措施:____________________。
(3)近几年,鸡禽流感在全球蔓延,注射流感疫苗成了预防流感的重要措施之一,流感疫苗作用的原理是___
____________________。试利用放射性同位素标记法探究:禽流感病毒的遗传物质是DNA还是RNA?请简述该实验的设计思路:___________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com