
7. ⑴1s22s22p63s23p63d84s2 ⑵正方体的八个顶点和六个面心 ⑶C ⑷极性 PCl3(或NCl3或NF3) ⑸HF先液化,因为HF分子间存在氢键,而HCl分子间没有,HF的沸点高于HCl
⑴1s22s22p63s23p63d84s2 ⑵正方体的八个顶点和六个面心 ⑶C ⑷极性 PCl3(或NCl3或NF3) ⑸HF先液化,因为HF分子间存在氢键,而HCl分子间没有,HF的沸点高于HCl
亮点:问题(2)来自于教材
7. 上世纪60年代,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念。在随后的几年内,科学家又相继合成了氙的氟化物、 氧化物等。
 ⑴Pt与Ni在周期表中位于同一族,写出基态Ni原子的核外电子排布式________________________________。
⑴Pt与Ni在周期表中位于同一族,写出基态Ni原子的核外电子排布式________________________________。
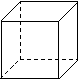
⑵金属Pt内部原子的堆积方式与铜相同,右图正方体是Pt晶胞的示意图,试说出Pt原子在晶胞中的位置__________________________。
⑶稀有气体(氡除外)中,只有较重的氙能含成出多种化合物,其可能原因是___________________(填字母代号)
A.氙的含量比较丰富 B.氙的相对原子质量大
C.氙原子半径大,电离能小 D.氙原子半径小,电负性大
 ⑷已知XeO3分子中氙原子上有1对孤对电子,则XeO3为____________分子(填“极性”或“非极性”),试写出一种由短周期主族元素组成的与XeO3互为等电子体的分子式________________________。
⑷已知XeO3分子中氙原子上有1对孤对电子,则XeO3为____________分子(填“极性”或“非极性”),试写出一种由短周期主族元素组成的与XeO3互为等电子体的分子式________________________。
⑸在一定压强下,将HF和HCl的混合气体降温时,哪一种物质首先液化?试解释其原因。________________________________________________________________。
6.(1)3d54s1
(2)sp3 ; 分子晶体
(3)N>O;三角锥形 , CO2,或CS2、N2O、BeCl2) CNO-
(4)HF分子之间有氢键,形成(HF)n
(5)Na2BeO2
(6)2∶3,(或8∶12、4∶6)
6. 下表为长式周期表的一部分,其中的编号代表对应的元素。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
 |
|
|
|
|
|
|
|
③ |
④ |
⑤ |
⑥ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑦ |
|
|
|
⑧ |
|
|
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
|
|
试填空。
 (1)写出上表中元素⑨原子的外围电子排布式
。
(1)写出上表中元素⑨原子的外围电子排布式
。
(2)元素③与⑧形成的化合物中元素③的杂化方式为: 杂化,其形成的化合物的晶体类型是:______________ _ _。
(3)元素④、⑤的第一电离能大小顺序是: > (用元素符号表示);元素④与元素①形成的X分子的空间构型为: 。请写出与N3-互为等电子体的分子、离子的化学式 , (各写一种)。
(4)在测定①与⑥形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是: 。
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH溶液反应后盐的化学式 。
(6)元素⑩在一定条件下形成的晶体的基本结构单元如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为: 。

5.(1)1S22S22P4;(2分)(2)H2S或NH2-;(2分)
(3)A;(1分)(4)BC;(1分)(5)20; (1分)
(6)Cu2++4H2O=[Cu(H2O)4]2+ (2分)
5.水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为 ;
(2)写出与H2O分子互为等电子体的微粒(写两种) 、 。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)
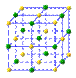

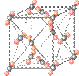
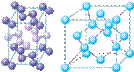
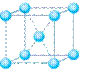
A B C D E
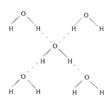 (5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了
一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:
。
4.(1)原子晶体 sp3 (各1分,共2分) (2)[Ar]3d104s24p5或1s22s22p63s23p63d104s24p5(1分) (3)开始有蓝色沉淀生成,随着氨水的滴入,沉淀的量逐渐增加至最多后开始溶解,最后蓝色沉淀完全消失,形成深蓝色的透明溶液 (2分) 深蓝色晶体析出 (1分) [Cu(NH3)4]SO4·H2O易溶于极性溶剂,难溶于极性较小或非极性溶剂 (1分) (4)SiH4 (1分) CH4与SiH4是组成与结构相似的物质,而CH4比SiH4的相对分子质量要小,分子间的作用力要小,所以熔点要低 (1分) (5)c(1分)
4.有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,C的外围电子构型为3d104s1。D位于A的下一个周期,是构成地球上矿物界的主要元素。请回答下列问题:
(1)元素A能形成多种单质,其中的一种单质能用作电极、润滑剂与制造铅笔等。A与D所形成的化合物属于 晶体,其中心原子是以 杂化成键;
(2)B的核外电子排布式为 ,
(3)向含有C的硫酸盐中逐滴滴加氨水,所观察到的现象是
;再向上述溶液中加入乙醇,有 ;原因是
;
(4)A的氢化物比D的氢化物相比,熔点高是的 ,理由是
;
(5)下列说法中正确的( )
a.岩浆晶出规则是晶格能高的晶体最后才析出
 b.钾型与铜型都是密置层堆积方式
b.钾型与铜型都是密置层堆积方式
c.在干冰晶体内,每一个CO2周围有12个紧邻的分子
d.邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点要高

3.(12分) (1)1s22s22p63s23p63d24s2 (2分) (2) sp2 (1分) c(1分)
(3)①ⅡA (1分) ②Si(1分);2(1分)
(4) SiC(1分);因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC 中C-Si 键键长比晶体Si 中Si-Si键短,键能大,因而熔沸点高(2分)
(5)CaTiO3(2分) ,
3.(1)金属钛(22Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,写出Ti元素的基态原子电子排布式为 __;
(2)COCl2俗称光气,分子中C原子采取 杂化成键;其中碳氧原子之间共价键含有 (填字母):
a.2个σ键;b.2个π键;c.1个σ键、1个π键。
(3)①短周期某主族元素M的逐级电离能情况如下图A所示,则M元素位于周期表的第 族
②第三周期8种元素按单质熔点高低的顺序如下图B所示,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图B中的序号)。


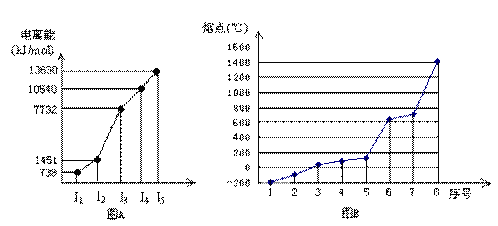
(4)由C原子跟Si原子以1 : 1相互交替结合而形成的晶体,晶型与晶体Si相同。两者相比熔点更高的是 (填化学式)试从结构角度加以解释: ______________________________________________________________________。
(5)某化合物的晶体中的晶胞堆积方式如下图所示:
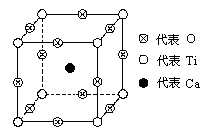
请回答:该化合物的化学式是: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com