
4.(09年全国理综卷I·28)(15分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g10.00%的K2SO4溶液,电极均为石墨电极。
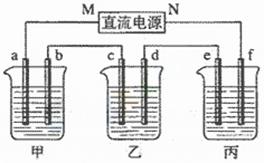
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
① 电源的N端为 极;
② 电极b上发生的电极反应为 ;
③ 列式计算电极b上生成的气体在标准状况下的体积: ;
④ 电极c的质量变化是 g;
⑤ 电解前后个溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ;
乙溶液 ;
丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
。
答案:(1)①正极 ②4OH--4e-=2H2O + O2↑。③2.8L ④16g ⑤甲增大,因为相当于电解水;乙减小,OH-放电, H+增多。丙不变,相当于电解水。(2)可以 因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应
3.(09年宁夏理综·37)[化学-选修化学与技术](15分)
请回答氯碱的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k= (要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是 (填序号)
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
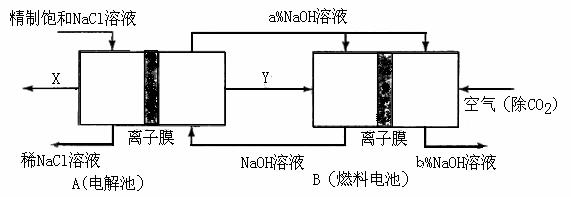 ①图中X、Y分别是
、 (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 ;
①图中X、Y分别是
、 (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 ;
②分别写出燃料电池B中正极、负极上发生的电极反应正极: ; 负极: ;
③这样设计的主要节(电)能之处在于(写出2处) 、 。
答案:(1)k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89(2)③①② (3)①Cl2 H2 a%小于b% ②O2+4e-+2H2O=4OH- H2-2e-+2OH-=2H2O ③燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度;降低能耗(其他合理答案也给分)
2.(09年江苏化学·16)(8分)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
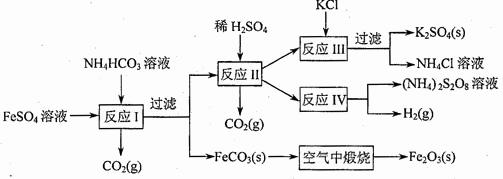
(1)反应I前需在FeSO4溶液中加入 (填字母),以除去溶液中的Fe3+。
A.锌粉 B.铁屑 C.KI溶液 D.H2
(2)反应Ⅰ需控制反应温度低于35℃,其目的是 。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是 。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为 。
答案:(1)B(2)防止NH4HCO3分解(或减少Fe2+的水解)
(3)降低K2SO4 的溶解度,有利于K2SO4 析出。
(4)2SO42- -2e- 2S2O82-
2S2O82-
1.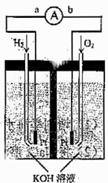 (09年天津理综·10)(14分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(09年天津理综·10)(14分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为 。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2
 2LIH
2LIH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
答案:(1)由化学能转化为电能 由a到b
(2)2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O
(3)增大电极单位面积吸附H2、O2分子数,加快电极反应速率
(4)①Li H2O ②或8.71×10-4 ③32
31、(1)Zn-2e- = Zn2+; 2H++2e- = H2↑。
(2)①锌片与银片减轻,是因与酸反应:
Zn+2H+ = Zn2++H2↑ - 转移2e-
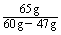 =
= 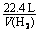 =
=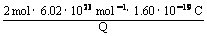
得V(H2) = 4.5 L; Q = 3.8×104 C。
31.(07年高考理综宁夏卷·26)(14分)(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应:_____________________________________;
银片上发生的电极反应:______________________________________。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况);
②通过导线的电量。(已知NA = 6.02×1023 /mol,电子电荷为1.60×10-19 C)
30、(1)铜(或Cu);AgNO3溶液。 (2)正, Ag++e- = Ag; Cu-2e- = Cu2+。 (3)负(Cu);正(Ag)。
30.(07年高考海南化学卷·14) (9分)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。


请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的________极,发生的电极反应为______________________________;
X电极上发生的电极反应为____________________________;
(3)外电路中的电子是从_______电极流向________电极。
29.(11分)(1)3、4、5、6 Fe-2e-=Fe2+(或2Fe-4e-=2Fe2+) O2+4e-+2H2O=4OH-(2)湿度、温度、O2的浓度、电解质存在 (3)电镀、发蓝等表面覆盖层,牺牲阳极的阴极保护法等(其他合理答案也给分)
29.(11分)(08年海南化学·29)如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
|
序号 |
内容 |
实验现象 |
|
1 |
常温下将铁丝放在干燥空气中一个月 |
干燥的铁丝表面依然光亮 |
|
2 |
常温下将铁丝放在潮湿空气中一小时 |
铁丝表面依然光亮 |
|
3 |
常温下将铁丝放在潮湿的空气中一个月 |
铁丝表面已变得灰暗 |
|
4 |
将潮湿的铁丝放在常温的氧气流中一小时 |
铁丝表面略显灰暗 |
|
5 |
将潮湿的铁丝放在高于常温的氧气流中一小时 |
铁丝表面已变得灰暗 |
|
6 |
将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 |
铁丝表面灰暗程度比实验5严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号) ;在电化学腐蚀中,负极反应是 ;正极反应是 。
(2)由该实验可知,可以影响铁锈蚀速率的因素是 。
(3)为防止铁的锈蚀,工业上普遍采用的方法是 (答两种方法)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com