
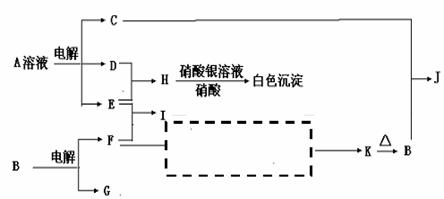
22.两个电解反应都是重要的化工反应,D、E、F、G为单质,D、E、G、H为气体,且只有E为有色气体,F是常见的金属单质, K是白色胶状沉淀,C的焰色反应为黄色,其物质间的转化关系如下,虚框内是需设计的内容,反应物只能用A-J中的物质:
(
(1)A的电子式 , H的结构式是 ;
(2)A溶液的电解方程式是 __________________________;
C+B→J的离子方程式是 ___ ;
(3)请设计F→K的最佳途径,(用框图形式表示)

(4)按设计得到1mol K,电解B时转移的电子数目是 ,至少需要另加试剂的物质的量是 : _____mol;
: _____mol; : _____mol(可不填满)。
21. .有一透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、HCO3-,取该溶液的实验如下:
|
实验步骤 |
实验现象 |
|
(1)取少量该溶液,加几滴甲基橙 |
溶液变红色 |
|
(2)向溶液中滴入碘化钾淀粉试液, |
溶液变蓝 |
|
(3)取少量该溶液,加BaCl2溶液 |
有白色沉淀生成 |
|
(4)取(3)中的上层清夜,加AgNO3 |
有稳定的白色沉淀生成,且不溶于稀硝酸 |
|
(5)取少量该溶液,加入NaOH溶液 |
有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断:
(1)溶液中一定存在的离子是____________________________;溶液中肯定不存在的离子是_______________________
(2)写出(5)中发生反应的离子方程式__________________________
______________________________________________________________
(3)为进一步确定其它离子,应该补充的实验及对应欲检验离子的名称(如为溶液反应,说明使用试剂的名称。不必写详细步骤)
______________________________________________________________
 ______________________________________________________________
______________________________________________________________
20. .有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为(还原性I->Fe2+>Br->Cl-)
A.7∶1 B.7∶2 C.7∶3 D.7∶4
第Ⅱ卷 非选择题
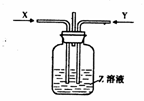
19.下列各组物质中,一定量的气体x和一定量的气体Y同时通人盛有溶液z的洗气瓶中(如图所示),最终肯定有沉淀生成的是(假定实验过程中不发生倒吸现象)
|
|
X |
Y |
Z |
|
A |
CO2 |
SO2 |
CaCl2 |
|
B |
NH3 |
SO2 |
BaCl2 |
|
C |
NH3 |
CO2 |
CaCl2 |
|
D |
Cl2 |
SO2 |
BaCl2 |
18. 对于某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32¯
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42¯
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
17.某强酸性溶液中可能存在NO3-、I-、Cl-、Fe3+中的一种或几种。向该溶液加入溴水后,溴被还原,由此推断该溶液中
(1).不含NO3-,也不含Fe3+ (2).含有NO3-、I-、Cl-
(3).含I-,但不能确定是否含Cl- (4).含有Fe3+
A.(1)(2) B.(3)(4) C.(1)(3) D.(2)(4
16.a mol FeS与b mol FeO投入到V L、c mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为:
① (a+b)×63g ② (a+b)×189g ③ (a+b)mol
④ (Vc-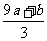 )mol
)mol
A、①④
B、②③  C、①③ D、②④
C、①③ D、②④
15.在一定条件下,将钠与氧气反应的生成物1.5g溶于水,所得溶液恰好能被80mL浓度为0.5mol/L的HCl溶液中和,则生成物的成分是
A.Na2O B.Na2O2 C.Na2O和Na2O2 D.Na2O2和NaO2
14.下列物质能同时倒入废液缸的是
A.亚硫酸钠溶液与盐酸 B. 硫化钠溶液与稀硫酸
C.硫酸钠溶液与BaCl2溶液 D. 浓盐酸和高锰酸钾溶液
13.已知下列物质氧化H2SO3时,自身发生如下变化:Cl2→2Cl-,MnO4-→Mn2+ ,Cr2O72-→2Cr3+,H2O2→2H2O。如果分别用等物质的量的这些物质氧化足量的H2SO3,得到H2SO4最多的是
A.Cr2O72- B.Cl2 C.MnO4- D.H2O2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com