
18.如下图所示的装置,c、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴人酚酞溶液,在F极附近显示红色。则以下说法正确的是 ( )
A.电源B极是正极
B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为l:2:1:1
C.欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
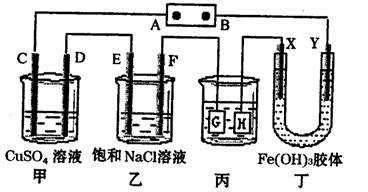 D.装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
D.装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
第Ⅱ卷(非选择题,共56分)
17.在密闭容器中,反应 ,达到平衡甲。下面的三个图形表示了在仅改变某一条件后,达到平衡乙的情况,对此过程的分析正确的是
,达到平衡甲。下面的三个图形表示了在仅改变某一条件后,达到平衡乙的情况,对此过程的分析正确的是
 ( )
( )
A.图I是加人适当催化剂的变化情况 B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况 D.图Ⅲ是升高温度的变化情况
16.在水电离的c(OH-)=1.0×10-11mol·L-1的溶液中,一定不能大量共存的离子组是
A.Fe2+、K+、C1-、NO-3 B.CO2-3、PO3-4、K+、Na+
C.Na+、HCO3、HS-、C1- D.NH+4、Fe3+、SO2-4、C1-
15.下列说法正确的是 ( )
A.某温度时,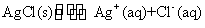 在水中沉淀溶解平衡后加入固体 NaCl,则AgCl的溶解度减小,Ksp也减小
在水中沉淀溶解平衡后加入固体 NaCl,则AgCl的溶解度减小,Ksp也减小
B.在0.1 moL/L的CH3COONa溶液中。离子浓度从大到小的顺序是:
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.甲烷碱性燃料电池在工作时,溶液中的OH-向负极移动
D.将0.1 mol/L的甲酸溶液加水稀释放10倍,溶液中所有离子的浓度都减小10倍
14.已知N4分子的结构和P4(白磷)分子的结构相似(正四面体),断裂1 mol N-N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。下列说法正确的是 ( )
A.N4与N2互为同素异形体
B.N4转变为N2将吸收热量
C.N4与P4互为同分异构体
D.制备N4的热化学方程式可表示为:N2(g)===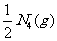 △H=+608
kJ·mol-1
△H=+608
kJ·mol-1
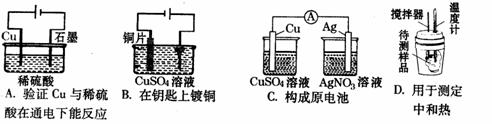
12.下列装置能达到实验目的是 ( )
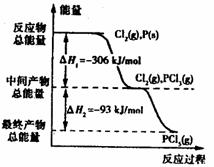 13.如图是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程和能量关系图。其中PCI5(g)分解成PCI3(g)和Cl2(g)的反应是一个可逆反应,温度代时,在密闭容器中加人0.6 mol PCI5,达平衡时PCl,还剩0.45mol,其分解率为
13.如图是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程和能量关系图。其中PCI5(g)分解成PCI3(g)和Cl2(g)的反应是一个可逆反应,温度代时,在密闭容器中加人0.6 mol PCI5,达平衡时PCl,还剩0.45mol,其分解率为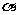 ,则下列推断不正确的是( )
,则下列推断不正确的是( )
A.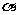 仪等于25%
仪等于25%
B.若升高温度,平衡时PCl5的分解率小于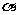
C.若超始时加入0.6mol PCl5和0.6 mol Cl2,
以相同条件进行反应,则平衡时PCl3转
化率为3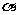
D.PCl5分解的热化学方程式为
PCl5(g) PCl3(g)+C12(g)
PCl3(g)+C12(g) H=一93kJ·mol-1
H=一93kJ·mol-1
11.下列说法中,不正确的是 ( )
A.用浓硫酸与蛋白质的颜色反应可以鉴别部分蛋白质。
B.乙酸与NaHCO2反应生成CO2气体,说明乙酸的酸性强于碳酸
C.将饱和Na2CO3溶液加人混有少量乙酸的乙酸乙酯中,然后分液可除去乙酸乙酯 中的少量乙酸
D.利用葡萄糖能跟新制Cu(OH)2悬浊液反应生成砖红色物质的原理检验病人是否 患“糖尿病”
10.下列各说法正确的是 ( )
A.对于 ,若向一密闭容器中加入1mtool
SO2和5 mol O2充分反应后,放出的热量为0.5 Q kJ
,若向一密闭容器中加入1mtool
SO2和5 mol O2充分反应后,放出的热量为0.5 Q kJ
B.热化学方程式中的化学计量数表示相应物质的量,不能用分数表示
C.需要加热才能发生的反应不一定是吸热反应
D.对于 ,反应前后熵不变
,反应前后熵不变
9.已知AgI为黄色沉淀,AgCI为白色沉淀,25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCI饱和溶液中c(Ag+)为1.3×10-5mol·L-1。若在5 mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,逐滴滴加8 mL 0.01 mol·L-1的AgNO3溶液,则下列叙述中不正确的是 ( )
A.溶液中所含溶质的离子浓度大小关系为: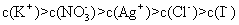
B.溶液中先产生的是AgI沉淀
C.AgCI的Ksp的数值为1.69×10-10
D.若在AgI悬浊液中滴加少量的KCI溶液,黄色沉淀不会转变成白色沉淀
8.在一容积可变的密闭容器中,aA(g) 6B(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则以下说法中不正确的是
6B(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则以下说法中不正确的是
( )
A.平衡向正方向移动了 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.化学计量数关系a<b
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com