
15.高铁酸钾K2FeO4是一种新型、高效、氧化性比Cl2更强的水处理剂,工业上通常用下列反应先制得高铁酸钾:2FeSO4+6Na2O2=2Na2FeSO4+2NaO2+2Na2SO4+O2↑,然后在某低温下,在高铁酸钾溶液中加KOH固体至饱和就可析出高铁酸钾,下列有关说法不正确的是 ( )
A.Na2O2在反应中既作氧化剂,又作还原剂
B.制取高铁酸钠时,每生成1molNa2FeSO4反应中共有4mol电子转移
C.高铁酸钾在该温度下的溶解度比高铁酸钾的溶解度小
D.K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮杂质
14.下列说法或表示法正确的是 ( )
A.等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多
B.由C(石墨)=====C(金刚石);△H+1.19kJ·mol-1可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与含1 molNaOH的溶液混合,放出的热量大于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l);△H=-285.8 kJ·mol-1
13. 人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37°C时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是 ( )
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37°C时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是 ( )
A.CO与HbO2反应的平衡常数
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
12.已知14mol/L的H2SO4溶液的溶质质量分数为80%,那么7mol/L的H2SO4溶液的溶质质量分数将 ( )
A.大于40% B.等于40% C.小于40% D.无法确定
11.对数据的分析归纳可得到科学的结论和规律。下列为某同学对数据的利用情况,其中不正确的是 ( )
A.根据非金属单质与氢气化合生成1mol产物时反应热的大小推测生成物的稳定性
B.用沸点数据推测用蒸馏法分离两种液体混合物的可能性
C.用熔点数据分析不同分子的稳定性
D.用同周期的元素的原子(离子)半径数据推断某些原子(离子)氧化性或还原性的相对强弱
9.下列实验不能达到预期目的是 ( )
|
序号 |
实验操作 |
实验目的 |
|
A |
Cl2、Br2分别与H2反应 |
比较氯、溴的非金属性强弱 |
|
B |
MgCl2、AlCl3溶液中分别通入NH3 |
比较镁、铝的金属性强弱 |
|
C |
测定Na2CO3、Na2SO4两溶液的pH |
比较碳、硫的非金属性强弱 |
|
D |
用同一电路测定等物质的量浓度的盐酸、醋酸两溶液的导电性 |
比较盐酸、醋酸的酸性强弱 |
 10.下列实验装置设计正确,且能达到目的的是:
10.下列实验装置设计正确,且能达到目的的是:
7.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,一般不需要使用玻璃棒进行操作的是 ( )
①用pH试纸测定Na2CO3溶液的pH
②将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体
③从氯酸钾和二氧化锰制取氧气的剩余固体中,经溶解,过滤,蒸发提取KCl
④探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
⑤用已知浓度的盐酸和未知浓度的氯氧化钠溶液进行中和滴定实验
⑥用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
⑦实验室用新制的FeSO4溶液和已处理过的NaOH溶液制备Fe(OH)2白色沉淀
A.②③⑦ B.②⑤⑦ C.②④⑤ D.②④⑥
 8.将某些化学知识用数轴表示直观形象、简明易记。下列用数轴表示正确的是 ( )
8.将某些化学知识用数轴表示直观形象、简明易记。下列用数轴表示正确的是 ( )
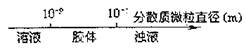 A.平衡常数与转化率关系:
A.平衡常数与转化率关系:
 B.分散系的分类:
B.分散系的分类:
C.AlCl3和NaOH反应后铝元素的存在形式:
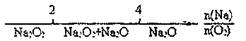
D.Na在O2中的燃烧产物:
5.设NA为阿伏加德罗常数,下列叙述中正确的是 ( )
A.标准状况下,22.4LCO2和O2混合气体中含有的氧分子数约为NA
B.常温常压下,0.1molFe在足量Cl2中充分燃烧,转移的电子数为0.2NA
C.标准状况下,11.2LNO与11.2LO2混合后所含原子数为2NA
D.电解精炼铜时,电解池中每转移1mol电子,阳极上溶解的铜原子数为0.5NA
 6.在一定温度时,N2与H2反应过程中能量变化的曲线如右图。下列叙述正确的是( )
6.在一定温度时,N2与H2反应过程中能量变化的曲线如右图。下列叙述正确的是( )
A.加入催化剂,该化学反应的放热增多
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂可增大正反应速率,降低逆反应速率
D.该反应的热化学方程式为:
 N2+3H2 2NH3 △H=-92kJ/moL
N2+3H2 2NH3 △H=-92kJ/moL
4.甲、乙、丙为二、三周期的元素,原子序数依次增大,甲和乙同周期,甲和丙同族,甲、乙原子序数之和与丙的原子序数相等,甲、丙原子的最外层电子数之和与乙原子的电子总数相等。下列说法中,不正确的是 ( )
A.乙是地壳中含量最多的元素
B.丙的氢化物比甲的氢化物热稳定性强
C.乙与丙形成的化合物可制作光导纤维
D.甲、乙两种元素形成的化合物中一定含有共价键
3.用右图表示的一些物质或概念间的从属关系中不正确的是 ( )
|
|
X |
Y |
|
||
|
A |
置换反应 |
氧化还原反应 |
化学反应 |
||
|
B |
胶体 |
分散系 |
混合物 |
||
|
C |
电解质 |
离子化合物 |
化合物 |
||
|
D |
碱性氧化物 |
金属氧化物 |
氧化物 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com