
2.若a<b<0,则下列不等关系中,不成立的是
A.︱a︱>︱b︱ B.a2>b2 C. D.
D.
1.直线x = 1的倾斜角为
A.0
B. C.
C. D.不存在
D.不存在
22.(16分)处理含铬(Cr)工业废水的原理是将Cr2O2-7
转化为Cr3+,再将Cr3+转化为沉淀。已知转化过程中,
废水pH与Cr2O2-7转化为Cr3+的关系如右图所示。
某研究小组为变废为宝,将废水处理得磁性材料
Cr0.5Fel1.5FeO4(Fe的化合价依次为+3、+2价)的
 实验流程如下:
实验流程如下:
(1)实验室中操作1所用的玻璃仪器名称是 。
(2)物质Y的化学式是 。
(3)步骤①中预处理的关键是 。
(4)步骤②中电解时,阳极的材料是 ,阴极的电极反应式为 ,
电解液中Cr2O2-7转化为Cr3+的离子方程式为 。
(5)含铬废水国家排放标准为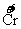 的含量≤0.1000mg/L,用
滴定管取上述溶液X 20.00mL,调节pH后置于锥形瓶中,用浓度为0.0001 mol/L的KI溶液滴定,至滴定终点时,用去KI溶液9.00mL。已知酸性条件下,I-被Cr2O2-7氧化为I2,则上述电解法处理后的废水中每升含
的含量≤0.1000mg/L,用
滴定管取上述溶液X 20.00mL,调节pH后置于锥形瓶中,用浓度为0.0001 mol/L的KI溶液滴定,至滴定终点时,用去KI溶液9.00mL。已知酸性条件下,I-被Cr2O2-7氧化为I2,则上述电解法处理后的废水中每升含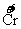 的质量为
mg。
的质量为
mg。
21.(12分)金属单质及其化合物与工农业生产、日常生活有密切的联系。请回答下列问题:
(1)一定温度下,氧化铁可以与一氧化碳发生如下反应:
 QkJ·mol-1
QkJ·mol-1
①该反应的平衡常数表达式K= ;
②该温度时,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,5 min后,生成了单质铁11.2 g,则这段时间内CO的反应速率为 ;
 ③达平衡后,若温度升高
③达平衡后,若温度升高 的值增大,则Q 0(填“>”、“=”、“<”)。
的值增大,则Q 0(填“>”、“=”、“<”)。
(2)工业常根据金属氢氧化物在酸中溶解
度不同,通过控制溶液的pH,达到分
离金属离子的目的。如右图是难溶金
属的氢氧化物在不同pH下的溶解情
况(s/mol·L-1)。若要除去CuCl2溶
液的少量Fe3+,应控制溶液的pH为
(填序号)。
A.小于l B.4左右
C.大于6 D.大于9
(3)某工业废水中含有Cu2+、Pb2+、Hg2+,
若向工业废水中加人过量的FeS,当
FeS、CuS、PbS和HgS共存时,溶液
中c(Fe2+):c(Pb2+):c(Hg2+)= : : 。
已知:Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(PbS)=3.4×10-28mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2,Ksp(HgS)=6.4×10-53mol2·L-2
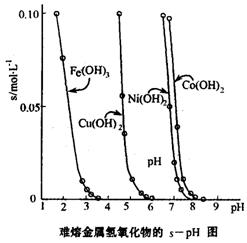
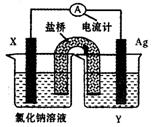 (4)依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是 (填序号)。
(4)依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是 (填序号)。
A.电极X的材料是Fe
B.电解质溶液Y是AgNO3溶液
C.原电池工作时,盐桥中的阴离子不断
移向左池的氯化钠溶液中
D.原电池工作时,x电极反应为:
 O2+2H2O+4e-→4OH-
O2+2H2O+4e-→4OH-
20.(14分)由我国自行研制的载人飞船“神舟七号”实现了中华民族的飞天梦想。为了飞船正常和稳定运行,且保证航天器座舱内容气成分的稳定,科学家进行了大量的科学探索。
方法一:有的科学家提出“金属过氧化物处理系统”,即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。
(1)有关反应的化学方程式是:_______________ ______;
_____________ ________。
(2)若平均每名航天员每天消耗0.96kg氧气,若以10天计算,每人至少消耗 kg过氧化钠。
方法二:有的科学家根据电化学原理设计了航天器座舱内空气更新系统,该系统结构示意图如下:

(1)管道①把飞船座舱中含有较多二氧化碳的潮湿空气通人A装置N极室,该装置可以为航天器提供电能,N极电极反应式为: ;二氧化碳被吸收后转化为CO2-3离子,通过膈膜CO2-3离子进入M极室,最后二氧化碳与该极反应的产物作用而放出,并保持整个系统的pH稳定,则M极电极反应式为
。
(2)航天员的生活用水可以由A装置提供,已知这种电池生成350 g水时能发电1度(约3600 kJ),能量的转化效率为 。
已知:2H2(g)+O2(g)===2H2O(l) △H=-572 kJ·mol-1
(3)管道②补充新鲜的氧气,供航天员呼吸,这些氧气来自B装置电解水系统,X极的电极反应式 。
19.(4分)某二元酸的化学式为H2A,常温下该酸在水溶液中的电离为:H2A===H++HA-,
 。请回答下列问题:
。请回答下列问题:
(1)Na2A的水溶液呈 (填“弱酸性”、“中性”、“弱碱性”),若用pH试纸去测定某溶液pH,简述操作 。
(2)写出NaHA的水溶液中溶质的电离常数表达式:Ka= 。
(3)若25℃时,0.10mol/L的NaHA溶液中c(A2-)=0.029mol/L,则0.10mol/L的H2A溶液中c(A2-) 0.029mol/L(填“<”、“>”、“=”),其理由是
。
(4)若25℃时,0.10mol/L-1H2A溶液中的pH=-1g 0.11,则0.10mol·L-1的H2A溶液中c(A2-)= 。
(5)在0.10mol/L的Na2A溶液中,下列离子浓度关系不正确的是 (填编号)。
A.c(Na+)===c(A2-)+c(HA-)+c(H2A)
B.c(OH-)==c(HA-)+c(H+)
C.c(Na+)+c(H+)===c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)===2c(A2-)+2c(HA-)
18.如下图所示的装置,c、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴人酚酞溶液,在F极附近显示红色。则以下说法正确的是 ( )
A.电源B极是正极
B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为l:2:1:1
C.欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
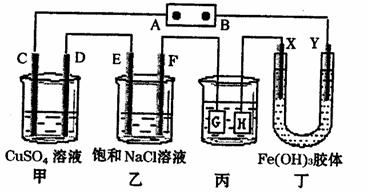 D.装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
D.装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
第Ⅱ卷(非选择题,共56分)
17.在密闭容器中,反应 ,达到平衡甲。下面的三个图形表示了在仅改变某一条件后,达到平衡乙的情况,对此过程的分析正确的是
,达到平衡甲。下面的三个图形表示了在仅改变某一条件后,达到平衡乙的情况,对此过程的分析正确的是
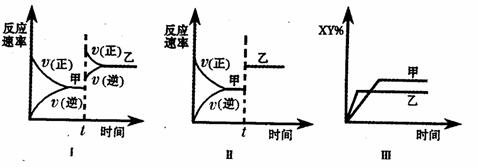 ( )
( )
A.图I是加人适当催化剂的变化情况 B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况 D.图Ⅲ是升高温度的变化情况
16.在水电离的c(OH-)=1.0×10-11mol·L-1的溶液中,一定不能大量共存的离子组是
A.Fe2+、K+、C1-、NO-3 B.CO2-3、PO3-4、K+、Na+
C.Na+、HCO3、HS-、C1- D.NH+4、Fe3+、SO2-4、C1-
15.下列说法正确的是 ( )
A.某温度时, 在水中沉淀溶解平衡后加入固体 NaCl,则AgCl的溶解度减小,Ksp也减小
在水中沉淀溶解平衡后加入固体 NaCl,则AgCl的溶解度减小,Ksp也减小
B.在0.1 moL/L的CH3COONa溶液中。离子浓度从大到小的顺序是:
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.甲烷碱性燃料电池在工作时,溶液中的OH-向负极移动
D.将0.1 mol/L的甲酸溶液加水稀释放10倍,溶液中所有离子的浓度都减小10倍
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com