
31、为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00 mL,加热至1200C左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(气体体积均折算到标准状况的体积):
|
实验序号 |
样品质量(克) |
NaOH溶液的体积(mL) |
氨气的体积(L) |
|
Ⅰ |
7.4 |
40.00 |
1.68 |
|
Ⅱ |
14.8 |
40.00 |
3.36 |
|
Ⅲ |
22.2 |
40.00 |
1.12 |
|
Ⅳ |
37.0 |
40.00 |
0.00 |
(1)实验过程中有关反应的离子方程式为:
; 。
(2)计算用1.85克样品进行同样实验时,生成氨气在标准状况的体积为 L
(3)计算确定该混合物中(NH4)2SO4和NH4HSO4的物质的量之比 。
(4)欲计算该NaOH溶液的物质的量浓度应选择第 组数据,由此求得NaOH溶液的物质的量浓度为 。
上海市部分重点中学2009学年高三第二次联考
30、已知: IO3-+5I-+6H+→3I2+3H2O。工业上利用NaIO3和NaHSO3反应来制取单质I2。
①NaIO3不足时:2NaIO3+6NaHSO3→2NaI+3Na2SO4+3H2SO4
②NaIO3足量时:4NaIO3+10NaHSO3→2I2+7Na2SO4+3H2SO4+2H2O
现模拟工业制取I2。在含31.2gNaHSO3的溶液中逐滴加入2mol/LNaIO3溶液vmL。
(1)当v= mL时,再滴NaIO3就开始析出I2 。
(2)当v为55mL时,生成的I2的质量为 g。
29、已知①一定下条件下,R-Cl+2Na+Cl-R′→R-R′+2NaCl
②醛和醇可以发生氧化反应,相关物质被氧化的难易次序是:
 R
R
 RCHO最易,R-CH2OH次之, CHOH最难
RCHO最易,R-CH2OH次之, CHOH最难
R
 现有某氯代烃A,其相对分子质量为78.5;B与氯气反应生成的一氯代物有两种。有关的
现有某氯代烃A,其相对分子质量为78.5;B与氯气反应生成的一氯代物有两种。有关的
转化关系如下图所示(部分产物及条件均已略去);

(1)分子式:A ;反应类型:A→C ,E→F ;
(2)结构简式:B ,K ;
(3)反应方程式:A→E 。
G→H 。
(4)D的同分异构体属于羧酸的有四种,其中有2个-CH3基团的有两种。请写出这两
种中的任一种结构简式为 。
28、对氨基苯甲酸甲酯是一种染料中间体,用对硝基甲苯为主要起始原料经下列反应制得:

请回答下列问题:
(1)写出A、C的结构简式:A , C 。
(2)A C的反应类型是 : 。
C的反应类型是 : 。
(3)用核磁共振氢谱可以证明化合物C中含有 种氢处于不同的化学环境。
(4)写出同时符合下列要求:①为1,4-二取代苯,其中苯环上的一个取代基是硝基;②
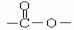
分子中含有结构的基团的C的所有同分异构体的结构简式: 。
(5)C的同分异构体中有一种在酸性条件下水解后得到的一种产物能与FeCl3溶液发生显色反应,写出该水解反应的化学方程式 ___________________ 。
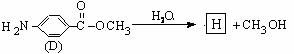 (6)D的水解反应如下:
(6)D的水解反应如下:
化合物H经聚合反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域。
请写出该聚合反应的化学方程式 。
27、工业上用铝土矿(含氧化铝、氧化铁)制取金属铝的生产过程如下框图
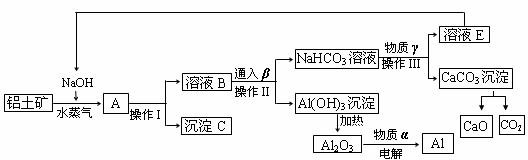
请回答下列问题:
(1)写出铝土矿与氢氧化钠溶液反应的离子方程式 。
(2)沉淀C的化学式为______,该物质除了用于金属冶炼以外,还可用作 。电解熔融的氧化铝时,物质α是______,其作用是 。
(3)在实验室中欲从溶液E中得到较纯净的固体NaOH,需要进行的操作顺序是:_______、趁热过滤、__________、 。
(4)生产过程中,可以循环使用的物质有四种,除NaOH、H2O以外,另外两种物质是
______、 (填化学式)。
26、 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3 更为合理,其理由是 _____________
_________________________________
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,检查该装置气密性的方法是 _
______________________ ,实验中需要测量的数据是 。
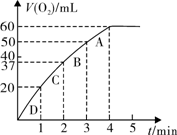 (3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
①写出H2O2在二氧化锰作用下发生反应的化学方程式 。
②实验时放出气体的总体积是 mL。
③放出 气体所需时间为 min。
气体所需时间为 min。
④反应放出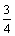 气体所需时间约为
min。
气体所需时间约为
min。
⑤A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
⑥解释反应速率变化的原因 。
⑦ 计算H2O2的初始物质的量浓度_____________mol/L。 (请保留两位有效数字)
25、工业制硝酸的主要反应是:
4NH3(g)+5O2(g)
 4NO(g)+6H2O
(g)+Q;Q =1025 kJ·mol-1
4NO(g)+6H2O
(g)+Q;Q =1025 kJ·mol-1
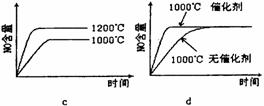
(1)该反应的平衡常数表达式为K=________________;升高温度K值__________ (填“增大”、“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填序号)。

(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
|
时间/浓度 |
c(NH3)(mol/L) |
C(O2)(mol/L) |
C(NO)(mol/L) |
|
起始 |
0.8 |
1.6 |
0 |
|
第2min |
0.6 |
a |
0.2 |
|
第4min |
0.3 |
0.975 |
0.5 |
|
第6min |
0.3 |
0.975 |
0.5 |
|
第8min |
0.8 |
1.6 |
0.5 |
①起始时物料比c (O2):c (NH3)>1.25,其原因是____________________________。
②反应在第2min到第4min时O2的平均反应速率为______________ mol/L·min;
③反应在第2min改变了反应条件,改变的条件可能是 ________ (填序号)
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是___________________________________。
24、某反应体系中,有反应物和生成物六种物质:HCl(浓)、KClO3、KCl、ClO2、Cl2、H2O。已知该反应中,KClO3发生了一个过程:KClO3→ClO2。ClO2是黄绿色易爆的气体。
(1) 写出并配平上述过程的化学方程式,并标出电子转移的方向和数目。
_____________________________________________________________
(2) 该反应中,盐酸体现了_______、_______性质。氧化剂是___________,反应后,若产生0.6mol气体,则转移电子的物质的量为___________mol。
(3) ClO2是一种广谱型的消毒剂,工业上ClO2常用NaClO3和Na2SO3溶液混合,并加H2SO4反应制得,在以上反应中,NaClO3和Na2SO3的物质的量之比为_________
23、下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为[填元素符号]_______________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是[填化学式]________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4) 由②和④组成,且②和④的质量比为3∶8的化合物的结构式是 ,
其中含________键,(填“极性”或“非极性”下同)属于________分子
该物质与⑤的同周期相邻主族元素的单质反应的化学方程式为 __
(5) ⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为 。
22、向200mL 0.5mol/L的稀硝酸溶液中加入0.54克铝粉,放出448mL(S.T.P)NO气体,经充分反应,向所得溶液中加入0.5mol/LNaOH溶液,生成0.78沉淀。加入氢氧化钠溶液的体积可能是( )
A.100mL B.150 mL C.180 mL D.200 mL
第II卷(非选择题,共84分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com