
26.(10分)(1)在25°C时,已知0.1mol/LHCN溶液的Ph=4,0.1mol/LnaCN溶液的pH=12。现将0.2mol/L的HCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液中各种离子的浓度有大到小的关系为 。
(2)常温下,将0.01molNH4Cl和0.002molNaOH溶于水,配制成0.5L混合溶液。试回答:
①溶液中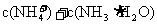 一定等于
一定等于
②溶液中n(OH-)+n(Cl-)-n(NH+4)= 。
II.某温度(t°C)时,水的离子积 ,则在此温度下,将pH=a的Ba(OH)2溶液VaL与pH=b的H2SO4溶液VbL混合:(假设混合后溶液体积等于混合前两溶液体积之和,所得固体体积忽略不计)
,则在此温度下,将pH=a的Ba(OH)2溶液VaL与pH=b的H2SO4溶液VbL混合:(假设混合后溶液体积等于混合前两溶液体积之和,所得固体体积忽略不计)
(1)若所得混合液为中性,且a=10,b=1,则Va:Vb= ;
(2)若所得混合液的Ph=2,且a=10,b=1,则Va:Vb= 。
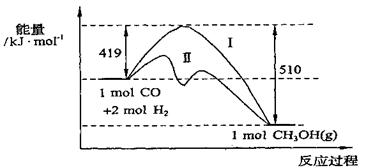
25. (10分)773K、VL固定容积的容器中发生反应:CO(g)+2H2(g)
CH3OH(g),具有重要意义,其过程中能量变化如下图。曲线II表示使用催化剂的能量变化。若投入amolCO、2amolH2,平衡时能生成0.1amolCH3OH,反应就具有工业应用价值。
(10分)773K、VL固定容积的容器中发生反应:CO(g)+2H2(g)
CH3OH(g),具有重要意义,其过程中能量变化如下图。曲线II表示使用催化剂的能量变化。若投入amolCO、2amolH2,平衡时能生成0.1amolCH3OH,反应就具有工业应用价值。
(1)在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可)
、 。
(2)下列与催化剂有关的说法中,正确的是 (填字母序号)
 A.使用催化剂,使反应
A.使用催化剂,使反应 CH3OH(g)
CH3OH(g)

B.使用催化剂,能够提高反应物转化率
C.使用催化剂,不能改变反应的平衡常数K
D.使用催化剂,不能提高反应速率
(3)下列说法不能证明反应达到平衡的是
A.混和气体的密度不变 B.混和气体的平均摩尔质量不变
C.一氧化碳的转化率不变 D.CH3OH(g)的浓度不变
(4)773K、VL固定容积的容器中,依据下列开始时物质的加入量,达到平衡时,CH3OH(g)的浓度与原题中的数值相等的是 (错答扣分)
A.2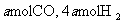
B.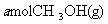
C.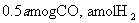
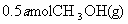
D.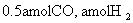
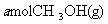
(5)用石墨作电极,一极通入空气,一极通入CH3OH(g),与KOH溶液可组成原电池,其负极反应式为: 。
24.(14分)甲、乙、丙三个实验小组分别进行测定Na2CO3和NaOH混合物中Na2CO3含量的实验。
(1)甲组:沉淀分析法(相对分子质量:Na2CO3为106;BaCO3为197;)
把mg混合物溶解后加入过量BaCl2溶液,然后将所得沉淀过滤、洗涤、烘干、称理,固体质量为wg,根据沉淀质量计算原混合物中Na2CO3质量分数为 。写出反应的离子方程式 。如果原溶液中过量的Ba2+浓度达到0.01mol/L,则溶液中残留的CO2-3的物质的浓度是 。(KSP(BaCO3)=2.58×10-9)
(2)乙组:气体分析法
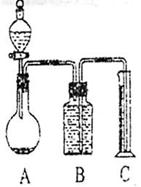
把mg混合物与过量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是 ,选用该溶液后实验结果还是不准确,
原因是 。针对上述问题乙组同学改用测定反应结束后容器A中溶质质量的方法测定Na2CO3和NaOH混合物中Na2CO3含量,如果在加热蒸发的过程中操作不当引起固体溅出,则测出的样品中Na2CO3的质量分数将 。(填“偏大”或“偏小”)
(3)丙组:滴定分析法
称量mg混合物试样于锥形瓶中,加水使之溶解后,加酚酞批示液2滴,用c mol/LHCl标准滴定溶液至溶液由红色恰好变为无色(Na2CO3+HCl===NaHCO3+NaCl),消耗HCl溶液V1mL,然后,加入甲基橙指示液1~2滴,继续用HCl标准滴定溶液滴定至溶液由黄色变为橙色(NaHCO3+HCl=NaCl+CO2↑+H2O),消耗HCl溶液V2mL。则样品中Na2CO3的质量分数为 (表达式可用含c,V1,V2)
23.(4分)化学是一门实验学科,下列实验操作、试剂保存方法和实验室事故处理,一定正确的是 (填序号,错选扣分)
A.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
B.制备氢氧化铁胶体时,向沸水中逐滴滴加1~2mL饱和的FeCl3溶液,并继续加热到液体呈透明的红褐色为止
C.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取待测溶液在pH试纸上,并与标准比色卡对比 ,读出pH值
D.实验室中,浓硝酸保存在带橡胶的棕色细口试剂瓶中
E.滴定操作时,为保证实验的准确性,滴定管和锥形瓶都要用待装溶液润洗
F.用于收集氨气的烧瓶用蒸馏水洗净后可直接收集氨气
G.用蒸馏瓶分离苯和甲苯的混和物时,温度计的水银球要插在蒸馏烧瓶的支管口处
22.已知常温下: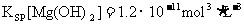
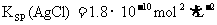
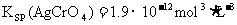
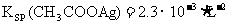 下列叙述正确的是 ( )
下列叙述正确的是 ( )
A.等体积混合浓度均为0.2mol/L的AgNO3溶液和CH3COONa溶液不一定产生CH3COOAg沉淀
B.将0.001mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001mol/L的K2CrO4溶液中先产生Ag2CrO4沉淀
C.在Mg2+为0.12mol/L的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上
D.向饱和AgCl水溶液中加入NaCl溶液,KSP(AgCl)变大
第Ⅱ卷(共56分)
21.下列叙述正确的是 ( )
A.常温下,10mL Ph=12的Ba(OH)2溶液与40mL c mol·L-1的NaHSO4溶液混合,当溶液中的Ba2+、SO2-4均恰好完全沉淀,若混合后溶液的体积为50mL,则溶液Ph=11
 B.某二元酸(H2A)在水中的电离方程式是:H2A===H++HA-,HA- H++A2-;则NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A)
B.某二元酸(H2A)在水中的电离方程式是:H2A===H++HA-,HA- H++A2-;则NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A)
C.Ph=12的氨水溶液与Ph=2的盐酸溶液等体积混合:
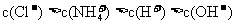
D.浓度均为0.1mol·L-1的小苏打溶液与烧碱溶液等体积混合:
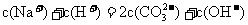
20.下列有关离子大量共存的说法正确的是 ( )
A.H+、Fe2+、SO2-4、NO-3因发生氧化还原反应而不能大量共存
B.水电离产生c(H+)=1×10-12mol/L的溶液中,可能有Mg2+、Na+、Cl-、HCO-3大量共存
C.澄清透明的无色溶液中,可能有ClO-、MnO-4、Al3+、SO2-4大量共存
D.在含大量Fe3+的溶液中,可能有NH+4、Na+、Cl‑、SCN-大量共存
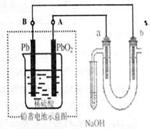
19.用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示
(a、b为石墨电极)。下列说法中正确的是 ( )
A.铅蓄电池放电时,只有负极(Pb)的质量增加
B.铅蓄电池充电时,A极应与外电源负极相连
C.电解苦卤水时,a电极首先放电的是Br-而不是Cl-,
说明当其它条件相同时Br-的还原性强于Cl-
D.当b极产生0.01mol气体时,铅蓄电池中消耗0.01molH2SO4
18.为检验某病人血液中含钙量,现取10mL血液样品稀释后用草酸铵[(NH4)2C2O4]处理成草酸钙沉淀,将此沉淀溶于过量的稀H2SO4中,然后用0.5mol/L KMnO4溶液(生成Mn2+、CO2、H2O)恰好消耗1.6mL,则该病人血液中含钙量为 ( )
 A.2.4g/L B.8g/L C.6g/L D.12g/L
A.2.4g/L B.8g/L C.6g/L D.12g/L
17. 下列离子方程式正确的是 ( )
下列离子方程式正确的是 ( )
A.用两个铜电极电解食盐水:2Cl-+2H2O 2OH-+H2↑+Cl2↑
B.用腐蚀法制作印刷线路板:Fe3++Cu===Fe2++Cu2+
C.Ca(HCO3)2溶液中加过量KOH溶液:Ca2++HCO-3+OH-=CaCO3↓+H2O
 D.AlCl3溶液呈酸性的原因:Al3++3H2O Al(OH)3+3H+
D.AlCl3溶液呈酸性的原因:Al3++3H2O Al(OH)3+3H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com