
33.(16分)
(1)光照 (2分) 、 Cu 加热 (2分)(只写一个条件给一分,或用加热符合标出也可)
(2)
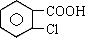 (2分)
(2分) 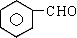 (2分)
(2分)
(3)
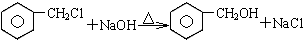 (2分)
(2分)
 (2分)
(2分)
(4)不能 ,因为酚羟基容易被氧化,如果互换则得不到水杨酸。 (2分)
(5)6 (2分)
化学专用字、词写错不得分,化学方程式、离子方程式中化学式或离子写错不得分。下列情况均扣1分:元素符号书写不规范、没配平或配平未全对、条件没写或写错、气体“↑”“↓”没写或写错、将“=”写成“→”。多项错误累计扣分,本空扣完为止。
汕头市2010年高三教学质量测评
理科综合(生物) 试题答案及评分标准
32.(16分)
(1)假设2:溶液中存在SO32-和HCO3- (2分)
假设3:溶液中存在HCO3-和SO42- (2和3顺序不限) (2分)
(2)(12分) (按表中注明的答题要点给分)
|
步骤编号 |
实验操作 |
预期现象和结论 |
|
① |
用胶头滴管取少量溶液加入试管A中,再用滴管取过量的lmol/L氯化钡溶液并滴入其中,充分反应后,静置,然后过滤,将沉淀和滤液分别装入另外的两个试管B、C中(4分) |
产生白色沉淀,说明原溶液中含有SO42-或SO32-或两者都有(2分) |
|
② |
往装有沉淀的试管B中加入过量的2mol/L盐酸,将产生的气体通入品红溶液(2分) |
沉淀部分溶解, 并产生气体. 品红褪色,说明原溶液中一定含有SO42-和SO32-(2分) |
|
③ |
往装有滤液的试管C中加入2mol/L盐酸; 或加入澄清石灰水(1分) |
出现无色气泡。 或澄清溶液变浑浊,说明原溶液中含有HCO3-(1分) |
|
其它方案合理给分 |
31.(16分)
(1)N2(g)+3H2(g)  2NH3(g) △H =-92.2 kJ·mol-1 (2分)
2NH3(g) △H =-92.2 kJ·mol-1 (2分)
(2) > (2分)
(3)25% (2分) ;0.01mol/(L·min) (1分);增大氢气浓度或增大氮气浓度或增大反应物浓度或降温或增大压强或及时转移走生成的氨(其它合理答案均得分)(1分)
(4)相等 (2分)
(5)4NH3+5O2 4NO+6H2O (2分)
4NO+6H2O (2分)
(6)不能;新法合成氨电解池的反应温度是570℃时,水为水蒸气;
阴 ; N2 + 6e- +6H+ == 2NH3 (4分,各1分)
30.(16分)
(1)④、⑧ (2分)
(2)阳极:Fe -2e-== Fe2+ (1分) ; 阴极:2H+ + 2e == H2↑ (1分)
溶液中:6Fe2+ + Cr2O72 -+ 14H+ == 6Fe3+ + 2Cr3+ + 7H2O (2分)
(3)2CrO42-
+ 2H+  Cr2O72- +
H2O (2分)
Cr2O72- +
H2O (2分)
(4)AgCl(2分)
(5)Cr3+ + 4OH- == CrO2- + 2H2O (2分)
Fe3+ + 3OH- == Fe(OH)3↓ (2分) Fe(OH)3 + 3H+ == Fe3+ + 3H2O (2分)
36.(18分)如图所示,在倾角θ=30º的斜面上放置一段凹槽B,B与斜面间的动摩擦因数μ=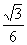 ,槽内靠近右侧壁处有一小球A,它到凹槽内左壁侧的距离d=0.10m.A、B的质量都为m=2.0kg,B与斜面间的最大静摩擦力可认为等于滑动摩擦力,不计A、B之间的摩擦,斜面足够长.现同时由静止释放A、B,经过一段时间,A与B的侧壁发生碰撞,碰撞过程不损失机械能,碰撞时间极短.取重力加速度g=10m/s2.求:
,槽内靠近右侧壁处有一小球A,它到凹槽内左壁侧的距离d=0.10m.A、B的质量都为m=2.0kg,B与斜面间的最大静摩擦力可认为等于滑动摩擦力,不计A、B之间的摩擦,斜面足够长.现同时由静止释放A、B,经过一段时间,A与B的侧壁发生碰撞,碰撞过程不损失机械能,碰撞时间极短.取重力加速度g=10m/s2.求:
(1)A与B的左侧壁第一次发生碰撞后瞬间A、B的速度.
 (2)在A与B的左侧壁发生第一次碰撞后到第二次碰撞前的这段时间内,A与B的左侧壁的距离最大可达到多少?
(2)在A与B的左侧壁发生第一次碰撞后到第二次碰撞前的这段时间内,A与B的左侧壁的距离最大可达到多少?
汕头市2010年高三教学质量测评
理科综合(化学)试题答案及评分标准
35.(18分)如图所示,PABCD是固定在竖直平面内的光滑绝缘轨道,其中PA是竖直轨道,ABCD是半径为R的圆弧轨道,两轨道在A点平滑连接.B、D分别为圆轨道的最低点和最高点, B、D连线是竖直直径,A、C连线是水平直径,P、D在同一水平线上.质量为m、电荷量为+q的小球从轨道上P点静止释放,运动过程电荷量保持不变,重力加速度为g.
(1)小球运动到B点时,轨道对小球的作用力有多大?
(2)当小球运动到C点时,突然在整个空间中加上一个方向竖直向上的匀强电场,电场强度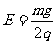 ,结果小球运动点D后水平射出,经过一段时间碰到了轨道的Q点,求Q点与P点间的距离s.
,结果小球运动点D后水平射出,经过一段时间碰到了轨道的Q点,求Q点与P点间的距离s.
34.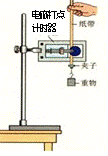 (1)(10分)电磁打点计时器是一种计时的仪器,使用时要注意调节好振针的高度,如果振针的位置过低,打出的纸带的点迹是 ,还会对纸带产生
,对实验结果有较大的影响.利用打点计时器和如图的其他器材可以开展多项实验探究,其主要步骤如下:
(1)(10分)电磁打点计时器是一种计时的仪器,使用时要注意调节好振针的高度,如果振针的位置过低,打出的纸带的点迹是 ,还会对纸带产生
,对实验结果有较大的影响.利用打点计时器和如图的其他器材可以开展多项实验探究,其主要步骤如下:
a、按装置安装好器材并连好电路
b、接通电源,释放纸带,让重锤由静止开始自由下落
c、关闭电源,取出纸带. 更换纸带,重复步骤b,打出几条纸带
d、选择一条符合实验要求的纸带,数据如图(相邻计数点的时间为T),
进行数据处理
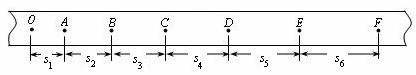
①若是探究重力做功和物体动能的变化的关系.需求出重锤运动到各计数点的瞬时速度,试表示在B点时重锤运动的瞬时速度VB= .
②若是测量重力加速度g. 为减少实验的偶然误差,采用逐差法处理数据,则加速度大小可以表示为g = .
③如果求出的加速度值与当地重力加速度公认的值g′有较大差距,说明实验过程存在较大的阻力,若要测出阻力的大小,则还需测量的物理量是___ ____.试用这些物理量和纸带上的数据符号表示出重锤在下落的过程中受到的平均阻力大小F=_ __ ____ .
(2)(8分)某实验小组要测量一电源的电动势E(约3V)和内阻r(约1Ω),现有下列器材:a、电压表V(3V和15V两个量程) b、电阻箱R(0~999.9Ω)
c、定值电阻R0=10Ω d、开关和导线。
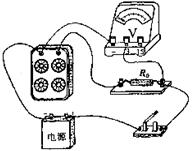
 其实验的实物连接图如图,请就下列问题作答:
其实验的实物连接图如图,请就下列问题作答:
①根据实物连接图在方框内画出实验电路图
②主要的实验步骤如下
a、闭合电键,将电阻箱的阻值调到R1,读得电压表的读数U1
b、将电阻箱的阻值调到R2,读得电压表的读数U2
c、由方程组U1 =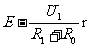 和U2=
和U2=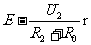 解出E和r
解出E和r
若考虑实验结果的准确性,请指出上述步骤有何不妥之处:
 ③若采用线性图象处理数据,请写出与线性图象对应的坐标轴表示的物理量(用字母符号表示)y轴:
, x轴:
.
③若采用线性图象处理数据,请写出与线性图象对应的坐标轴表示的物理量(用字母符号表示)y轴:
, x轴:
.
33.(16分)
从甲苯出发,按下面流程可以合成苯甲酸苯甲酯和水杨酸。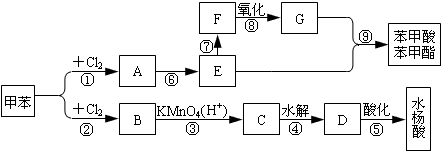
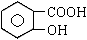
已知水杨酸的结构简式为 ,请回答:(1)写出下列反应的条件:① 、⑦ ;
(2)C、F的结构简式分别为C 、F ;
(3)写出反应⑥、⑨的化学方程式:
⑥ ⑨ ;
(4)③、④两步反应能否互换,为什么? 。
(5)同时符合下列条件的水杨酸的同分异构体共有 种。
①苯环上有3个取代基 ②能发生银镜反应 ③与足量NaOH溶液反应可消耗2molNaOH
32.(16分)
某溶液中可能含有SO32-、SO42-、 HCO3- 三种离子中的两种或三种。为探究其组成,小明取出两份相同的样品溶液于试管中,向一份中加入过量的盐酸,产生无色气泡;向另一份中滴加过量的氯化钡溶液,产生白色沉淀。请设计合理实验,做进一步的探究,对小明的实验给出结论。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、集气瓶、铁架台、漏斗、滤纸、酒精灯、带单孔胶塞的导管;lmol/L硫酸;2mol/L盐酸;2mol/L硝酸、;lmol/L氯化钡、澄清石灰水、品红溶液、蒸馏水。
完成下列探究过程:
(1)提出假设:
假设l:溶液中存在SO32-、SO42- 假设2: ;
假设3: ;假设4:溶液中存在SO32-、SO42-、 HCO3-
(2)基于假设4 , 设计出实验方案,将实验操作、预期的实验现象和结论填在下表中。
[提示] I、在答题卡上按照下表的方式作答,注意前后内容的对应。
Ⅱ、注意文字简洁,超出答题卡空间视为无效。
III 、可不填满,也可增加步骤。
|
步骤编号 |
实验操作 |
预期现象和结论 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
|
…… |
…… |
…… |
31.(16分)
现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高。
⑴ 已知1 mol N2(g)与适量H2(g)完全反应,生成NH3(g),放出92.2 kJ热量,写出反应的热化学方程式: 。
⑵若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1 K2(填“>” “=” 或 “<” )。
⑶在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为 ,用氮气表示的反应速率为: 。若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:
(任意写一条)。
⑷在上述相同条件下,若起始时加入4 mol NH3、2 mol H2及固体催化剂,反应达到平衡时NH3的体积分数比(3)中 (填“大”、“小”或“相等”)。
⑸氨被氧化生成一氧化氮的化学方程式为: 。
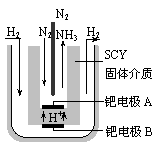 ⑹随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如右图)。
⑹随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如右图)。
请回答:在电解法合成氨的电解池中 (填“能”或“不能”) 用水作电解质溶液的溶剂,原因是 。
钯电极A是电解池的 极(填“阳”或“阴”),该极上的电极反应式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com