
(一)有机
1. 不饱和烃(烯烃、炔烃、二烯烃、苯乙烯等);
2. 不饱和烃的衍生物(烯醇、烯醛、油酸、油酸盐、油酸某酯、油等)
3. 石油产品(裂化气、裂解气、裂化汽油等);
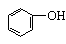
4. 苯酚及其同系物(因为能与溴水取代而生成三溴酚类沉淀)
5. 含醛基的化合物
6. 天然橡胶(聚异戊二烯)
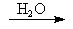
A ↓(白)+ ↑(无色) (A:CaC2、Al2S3、Mg3N2)
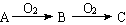 (A:S、H2S、N2、Na、醇)
(A:S、H2S、N2、Na、醇)
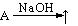 (A:铵盐、Al、Si、CH3COONa)
(A:铵盐、Al、Si、CH3COONa)
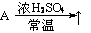 (A:氯化物)
(A:氯化物)
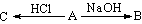 (A:Al、(NH4)2CO3、NH4HCO3、NaHCO3、NaHS、(NH4)2S、NH4HS、氨基酸)
(A:Al、(NH4)2CO3、NH4HCO3、NaHCO3、NaHS、(NH4)2S、NH4HS、氨基酸)
中学化学常见气体单质:H2、O2、N2、Cl2、(F2)
固体单质:S、Na、Mg、Al、Fe、Cu
液体单质:Br2
中学化学常见化合物:NaCl、NaOH、Na2CO3、NaHCO3、FeCl2、FeCl3、H2SO4、
HCl、CaCO3、SO2、H2O、NO、NO2、HNO3
化学工业
|
制备的物质 |
反应原理 |
设备 |
 |
分离液态空气 |
|
 |
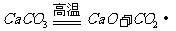 |
|
|
漂白粉和漂粉精 |
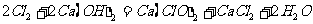 |
|
|
玻璃 |
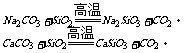 |
玻璃熔炉 |
|
合成氨 |
 |
合成塔 |
 |
 |
氧化炉、吸收塔 |
 |
 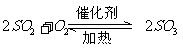 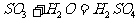 |
沸腾炉、接触室、吸收塔 |
|
炼铁 |
 |
高炉 |
|
氯碱工业 |
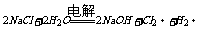 |
电解槽 |
|
炼铝 |
 |
电解槽 |
|
精炼铜 |
阳极 阴极 |
|
|
电镀铜 |
阳极 阴极 |
|
Ⅲ、有机化学
最简式相同的有机物
1. CH:C2H2和C6H6
2. CH2:烯烃和环烷烃
3. CH2O:甲醛、乙酸、甲酸甲酯
4. CnH2nO:饱和一元醛(或饱和一元酮)与二倍于其碳原子数和饱和一元羧酸或酯;举一例:乙醛(C2H4O)与丁酸及其异构体(C4H8O2)
同分异构体
1、醇--醚 CnH2n+2Ox
2、醛-酮-环氧烷(环醚) CnH2nO
3、羧酸-酯-羟基醛 CnH2nO2
4、氨基酸-硝基烷
能发生取代反应的物质及反应条件
1. 烷烃与卤素单质:卤素蒸汽、光照;
2. 苯及苯的同系物与①卤素单质:Fe作催化剂;
②浓硝酸:50-60℃水浴;浓硫酸作催化剂
③浓硫酸:70-80℃水浴;
3. 卤代烃水解:NaOH的水溶液;
4. 醇与氢卤酸的反应:新制的氢卤酸;
5. 酯类的水解:无机酸或碱催化;
6. 酚与浓溴水或浓硝酸:(乙醇与浓硫酸在140℃时的脱水反应,事实上也是取代反应。)
能发生加成反应的物质
1. 烯烃的加成:卤素、H2、卤化氢、水
2. 炔烃的加成:卤素、H2、卤化氢、水
3. 二烯烃的加成:卤素、H2、卤化氢、水
4. 苯及苯的同系物的加成:H2、Cl2
5. 苯乙烯的加成:H2、卤化氢、水、卤素单质
6. 不饱和烃的衍生物的加成:(包括卤代烯烃、卤代炔烃、烯醇、烯醛、烯酸、烯酸酯、烯酸盐等)
7. 含醛基的化合物的加成:H2、HCN等
8. 酮类物质的加成:H2
9. 油酸、油酸盐、油酸某酯、油(不饱和高级脂肪酸甘油酯)的加成。
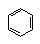
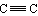 能与氢气加成的: 、C=C、 、C=O
能与氢气加成的: 、C=C、 、C=O
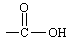
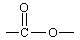
( 和 中的C=O双键不发生加成)
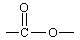
能与NaOH反应的:-COOH、 、 、
能发生加聚反应的物质
烯烃、二烯烃、乙炔、苯乙烯、烯烃和二烯烃的衍生物。
能发生缩聚反应的物质
1. 苯酚和甲醛:浓盐酸作催化剂、水浴加热
2. 二元醇和二元羧酸等
缩合聚合(简称缩聚):单体之间通过脱去小分子(如H2O等)生成高分子的反应。例如:
能发生银镜反应的物质
凡是分子中有醛基(-CHO)的物质均能发生银镜反应。
1. 所有的醛(R-CHO);
2. 甲酸、甲酸盐、甲酸某酯;
注:能和新制Cu(OH)2反应的--除以上物质外,还有酸性较强的酸(如甲酸、乙酸、丙酸、盐酸、硫酸、氢氟酸等),发生中和反应。
能与溴水反应而使溴水褪色或变色的物质
(二)有机的:天然气(又叫沼气、坑气,主要成分为CH4)
液化石油气(以丙烷、丁烷为主) 裂解气(以CH2=CH2为主) 焦炉气(H2、CH4等)
电石气(CH≡CH,常含有H2S、PH3等)
3、具有漂白作用的物质
|
氧化作用 |
化合作用 |
吸附作用 |
|
Cl2、O3、Na2O2、浓HNO3 |
SO2 |
活性炭 |
|
化学变化 |
物理变化 |
|
|
不可逆 |
可逆 |
※其中能氧化指示剂而使指示剂褪色的主要有Cl2(HClO)和浓HNO3及Na2O2
4、能升华的物质
I2、干冰(固态CO2)、升华硫、红磷,萘。(蒽和苯甲酸作一般了解)。
5、Fe3+的颜色变化
1、向FeCl3溶液中加几滴KSCN溶液呈红色;
2、FeCl3溶液与NaOH溶液反应,生成红褐色沉淀;
3、向FeCl3溶液溶液中通入H2S气体,生成淡黄色沉淀;
4、向FeCl3溶液中加入几滴Na2S溶液,生成淡黄色沉淀;
当加入的Na2S溶液过量时,又生成黑色沉淀;
5、向FeCl3溶液中加入过量Fe粉时,溶液变浅绿色;
6、向FeCl3溶液中加入过量Cu粉,溶液变蓝绿色;
7、将FeCl3溶液滴入淀粉KI溶液中,溶液变蓝色;
8、向FeCl3溶液中滴入苯酚溶液,溶液变紫色
6、“置换反应”有哪些?
1、较活泼金属单质与不活泼金属阳离子间置换
如:Zn+Cu2+==Zn2++Cu Cu+2Ag+=2Ag
2、活泼非金属单质与不活泼非金属阴离子间置换
Cl2+2Br‾==2Cl‾+Br2 I2+S2−==2I‾+S 2F2+2H2O==4HF+O2
3、活泼金属与弱氧化性酸中H+置换
2Al+6H+==2Al3−+3H2↑ Zn+2CH3COOH==Zn2++2CH3COO‾+H2↑
4、金属单质与其它化合物间置换
2Mg+CO22MgO+C 2Mg+SO22 MgO+S
2Na+2H2O==2Na++2OH‾+H2↑
2Na+2C6H5OH(熔融)→2C6H5ONa+H2↑
2Na+2C2H5OH→2C2H5ONa+H2↑
10Al+3V2O55Al2O3+6V 8Al+3Fe3O44 Al2O3+9Fe
2FeBr2+3Cl2==2FeCl3+2Br2 2 FeI2+3Br2==2FeBr3+2I2
Mg+2H2OMg(OH)2+H2↑ 3Fe+4H2O(气)Fe3O4+4 H2↑
5、非金属单质与其它化合物间置换
H2S+X2==S↓+2H++2X‾ 2H2S+O2(不足)2S+2H2O
CuO+CCu+CO↑ CuO+H2Cu+H2O SiO2+2CSi+2CO↑
3Cl2+8NH3==6NH4Cl+N2
3Cl2+2NH3==6HCl+N2
7、条件不同,生成物则不同
1、2P+3Cl22PCl3(Cl2不足) ;2P+5Cl22 PCl5(Cl2充足)
2、2H2S+3O22H2O+2SO2(O2充足) ;2H2S+O22H2O+2S(O2不充足)
3、4Na+O22Na2O 2Na+O2Na2O2
4、Ca(OH)2+CO2CaCO3↓+H2O ;Ca(OH)2+2CO2(过量)==Ca(HCO3)2↓
5、2Cl2+2 Ca(OH)2==Ca(ClO)2+CaCl2+2H2O
6Cl2+6 Ca(OH)2Ca(ClO3)2+5CaCl2+6H2O
6、C+O2CO2(O2充足) ;2 C+O22CO (O2不充足)
7、8HNO3(稀)+3Cu==2NO↑+2Cu(NO3)2+4H2O
4HNO3(浓)+Cu==2NO2↑+Cu(NO3)2+2H2O
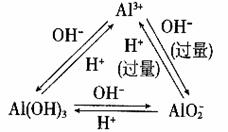
10、AlCl3+3NaOH==Al(OH)3↓+3NaCl ;
AlCl3+4NaOH(过量)==NaAlO2+2H2O
11、NaAlO2+4HCl(过量)==NaCl+2H2O+AlCl3
NaAlO2+HCl+H2O==NaCl+Al(OH)3↓
12、Fe+6HNO3(热、浓)==Fe(NO3)3+3NO2↑+3H2O
Fe+HNO3(冷、浓)→(钝化)
13、Fe+6HNO3(热、浓)Fe(NO3)3+3NO2↑+3H2O
Fe+4HNO3(热、浓)Fe(NO3)2+2NO2↑+2H2O
14、Fe+4HNO3(稀)Fe(NO3)3+NO↑+2H2O
|
|
 CH2=CH2↑+H2O
CH2=CH2↑+H2O
|
|
 C2H5-O-C2H5+H2O
C2H5-O-C2H5+H2O
16、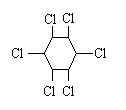
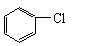
 +Cl2 +HCl
+Cl2 +HCl
 +3Cl2
(六氯环已烷)
+3Cl2
(六氯环已烷)
17、C2H5Cl+NaOH C2H5OH+NaCl C2H5Cl+NaOHCH2=CH2↑+NaCl+H2O
18、6FeBr2+3Cl2(不足)==4FeBr3+2FeCl3 2FeBr2+3Cl2(过量)==2Br2+2FeCl3
8、滴加顺序不同,现象不同
1、AgNO3与NH3·H2O:
AgNO3向NH3·H2O中滴加--开始无白色沉淀,后产生白色沉淀
NH3·H2O向AgNO3中滴加--开始有白色沉淀,后白色沉淀消失
2、Ca(OH)2与H3PO4(多元弱酸与强碱反应均有此情况):
Ca(OH)2向H3PO4中滴加--开始无白色沉淀,后产生白色沉淀
H3PO4向Ca(OH)2中滴加--开始有白色沉淀,后白色沉淀消失
3、NaOH与AlCl3:
NaOH向AlCl3中滴加--开始有白色沉淀,后白色沉淀消失
AlCl3向NaOH中滴加--开始无白色沉淀,后产生白色沉淀
4、HCl与NaAlO2:
HCl向NaAlO2中滴加--开始有白色沉淀,后白色沉淀消失
NaAlO2向HCl中滴加--开始无白色沉淀,后产生白色沉淀
5、Na2CO3与盐酸:
Na2CO3向盐酸中滴加--开始有气泡,后不产生气泡
 盐酸向Na2CO3中滴加--开始无气泡,后产生气泡
盐酸向Na2CO3中滴加--开始无气泡,后产生气泡
9、常用反应
Al3+ + 4OH- = AlO2- +2H2O
3AlO2- + Al3+ + 6H2O = 4 Al (OH)3
2CO2 + 2Na2O2 = 2Na2CO3 + O2 △m = 56g
2H2O + 2Na2O2 = 4NaOH + O2 △m = 4g
 AlO2-
+ CO2 + 2H2O = Al (OH)3↓+ HCO3-
AlO2-
+ CO2 + 2H2O = Al (OH)3↓+ HCO3-
2NaCl + MnO2 + 3H2SO4 2NaHSO4 + MnSO4 + Cl2↑+ 2H2O
10、特殊反应
2F2 + 2H2O = 4HF + O2
Si +2NaOH + H2O = Na2SiO3 + 2H2↑
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
(一)无机的:爆鸣气(H2与O2); 水煤气或煤气(CO与H2);碳酸气(CO2)
(二)混合物:氨水(分子:NH3、H2O、NH3·H2O;离子:NH4+、OH‾、H+)
氯水(分子:Cl2、H2O、HClO;离子:H+、Cl‾、ClO‾、OH‾)
苏打水(Na2CO3的溶液) 生理盐水(0.9%的NaCl溶液)
水玻璃(Na2SiO3水溶液) 卤水(MgCl2、NaCl及少量MgSO4)
水泥(2CaO·SiO2、3CaO·SiO2、3CaO·Al2O3) 王水(由浓HNO3和浓盐酸以1∶3的体积比配制成的混合物)
2、各种“气”汇集
(一)纯净物:重水D2O;超重水T2O;蒸馏水H2O;双氧水H2O2;水银Hg; 水晶SiO2。
(1)恒压下通稀有气体,平衡移动方向相当于直接减压(也同于稀释对溶液中反应的影响);
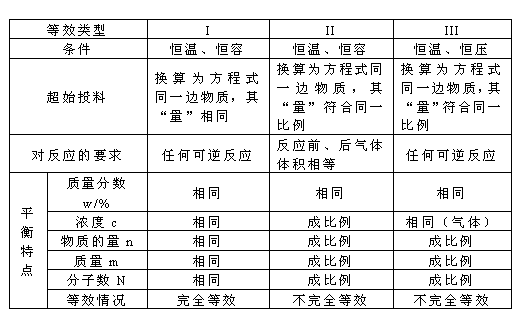 (2)恒容下通稀有气体,平衡不移动. 注意:只要与平衡混合物的物质不反应的气体都可称”稀有”气体
(2)恒容下通稀有气体,平衡不移动. 注意:只要与平衡混合物的物质不反应的气体都可称”稀有”气体
Ⅱ、元素及其化合物
1、各种“水”汇集
如果改变影响平衡的一个条件(浓度,温度,压强等)平衡就向减弱这种改变的方向移动.
(1)浓度:在其它条件不变的情况下,增大反应物的浓度或减小生成物的浓度,平衡向正反应方向移动;反之向逆反应方向移动;
(2)压强:在其它条件不变的情况下,增大压强会使平衡向气体体积缩小的方向移动;减小压强平衡向气体体积增大的方向移动;注意:①对于气体体积相同的反应来说,增减压强平衡不移动; ②若平衡混合物都是固体或液体,增减压强平衡也不移动; ③压强变化必须改变了浓度才有可能使平衡移动.
(3)温度:在其它条件下,升高温度平衡向吸热方向移动;降低温度平衡向放热方向移动.(温度改变时,平衡一般都要移动)注意:催化剂同等倍数加快或减慢正逆反应的速率,故加入催化剂不影响平衡,但可缩短达到平衡的时间.
内因:反应物的性质
外因 浓度↗ v↗ 压强↗ v↗(气体)
温度↗ v↗ 催化剂 v↗(正催化剂)
其它(光,超声波,激光,放射线,电磁波,反应物颗粒大小,扩散速率,溶剂等)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com