
(二)无机
①-2价硫的化合物(H2S、氢硫酸、硫化物);②+4价硫的化合物(SO2、H2SO3及亚硫酸盐);
③双氧水(H2O2,其中氧为-1价)
66、 最简式相同的有机物
①.CH:C2H2和C6H6
②.CH2:烯烃和环烷烃
③.CH2O:甲醛、乙酸、甲酸甲酯、葡萄糖
④.CnH2nO:饱和一元醛(或饱和一元酮)与二倍于其碳原子数和饱和一元羧酸或酯;举一例:乙醛(C2H4O)与丁酸及其异构体(C4H8O2)
最简式相同的有机物,不论以何种比例混合,只要混和物总质量一定,完全燃烧生成的CO2、H2O及耗O2的量是不变的。恒等于单一成分该质量时产生的CO2、H2O和耗O2量。
67、 n+1个碳原子的一元醇与n个碳原子的一元酸相对分子量相同。
68、 有机推断题中常用的反应条件:①光照,烷烃卤代,产物可能有多种;②浓硝酸浓硫酸加热,芳烃硝化;③NaOH水溶液加热,卤代烃或酯水解;④NaOH醇溶液,卤代烃消去成烯;⑤NaHCO3有气体,一定含羧基;⑥新制Cu(OH)2或银氨溶液,醛氧化成酸;⑦铜或银/O2加热,一定是醇氧化;⑧浓硫酸加热,可能是醇消去成烯或酸醇酯化反应;⑨稀硫酸,可能是强酸制弱酸或酯水解反应;⑩浓溴水,可能含有酚羟基。
69、 羟基官能团可能发生反应类型:取代、消去、酯化、氧化、缩聚、中和反应
70、 分子式为C5H12O2的二元醇,主链碳原子有3个的结构有2种
71、 常温下,pH=11的溶液中水电离产生的c(H+)是纯水电离产生的c(H+)的10-4倍
72、 甲烷与氯气在紫外线照射下的反应产物有5种
73、 棉花和人造丝的主要成分都是纤维素
74、 酯的水解产物只可能是酸和醇;酯的水解产物也可能是酸和酚
75、 裂化汽油、裂解气、活性炭、粗氨水、石炭酸、CCl4、焦炉气等都能使溴水褪色
76、 有机物不一定易燃烧。如四氯化碳不易燃烧,而且是高效灭火剂。
77、 误认为二氯甲烷有两种结构。因为甲烷不是平面结构而是正四面体结构,故二氯甲烷只有一种结构。
78、 误认为碳原子数超过4的烃在常温常压下都是液体或固体。新戊烷是例外,沸点 9.5℃,气体。
79、 误认为聚乙烯是纯净物。聚乙烯是混合物,因为它们的相对分子质量不定。
80、 误认为苯和溴水不反应,故两者混合后无明显现象。虽然二者不反应,但苯能萃取水中的溴,故看到水层颜色变浅或褪去,而苯层变为橙红色。
81、 误认为用酸性高锰酸钾溶液可以除去苯中的甲苯。 甲苯被氧化成苯甲酸,而苯甲酸易溶于苯,仍难分离。应再用氢氧化钠溶液使苯甲酸转化为易溶于水的苯甲酸钠,然后分液。
82、 误认为卤代烃一定能发生消去反应。误认为醇一定能发生消去反应。 甲醇和邻碳无氢的醇不能发生消去反应。
83、 误认为烃基和羟基相连的有机物一定是醇类。苯酚是酚类。
84、 误认为欲除去苯中的苯酚可在其中加入足量浓溴水,再把生成的沉淀过滤除去。苯酚与溴水反应后,多余的溴易被萃取到苯中,而且生成的三溴苯酚虽不溶于水,却易溶于苯,所以不能达到目的。
85、 误认为只有醇能形成酯,而酚不能形成酯。酚类也能形成对应的酯,如阿司匹林就是酚酯。但相对于醇而言,酚成酯较困难,通常是与羧酸酐或酰氯反应生成酯。
86、 误认为饱和一元醇被氧化一定生成醛。 当羟基与叔碳连接时被氧化成酮,如2-丙醇。
87、 误认为相对分子质量相同但分子结构不同的有机物一定是同分异构体。乙烷与甲醛、丙醇与乙酸相对分子质量相同且结构不同,却不是同分异构体。
88、 误认为相对分子质量相同,组成元素也相同,分子结构不同,这样的有机物一定是同分异构体。乙醇和甲酸。
89、 误认为分子组成相差一个或几个CH2原子团的物质一定是同系物。
乙烯与环丙烷。
(一)有机
①不饱和烃(烯烃、炔烃、二烯烃、苯乙烯等);
②苯的同系物;
③不饱和烃的衍生物(烯醇、烯醛、烯酸、卤代烃、油酸、油酸盐、油酸酯等);
④含醛基的有机物(醛、甲酸、甲酸盐、甲酸某酯等);
⑤石油产品(裂解气、裂化气、裂化汽油等);
⑥煤产品(煤焦油);
⑦天然橡胶(聚异戊二烯)。
(二)无机
①.-2价硫(H2S及硫化物);
②.+4价硫(SO2、H2SO3及亚硫酸盐);
③.+2价铁:
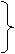 6FeSO4+3Br2=2Fe2(SO4)3+2FeBr3
6FeSO4+3Br2=2Fe2(SO4)3+2FeBr3
6FeCl2+3Br2=4FeCl3+2FeBr3 变色
2FeI2+3Br2=2FeBr3+2I2
④.Zn、Mg等单质 如Mg+Br2MgBr2 (此外,其中亦有Mg与H+、Mg与HBrO的反应)
⑤.-1价的碘(氢碘酸及碘化物) 变色
⑥.NaOH等强碱:Br2+2OH‾==Br‾+BrO‾+H2O
⑦.AgNO3
65、 能使酸性高锰酸钾溶液褪色的物质
(一)有机
①.不饱和烃(烯烃、炔烃、二烯烃、苯乙烯等);
②.不饱和烃的衍生物(烯醇、烯醛、油酸、油酸盐、油酸某酯、油等)
③.石油产品(裂化气、裂解气、裂化汽油等);
④.苯酚及其同系物(因为能与溴水取代而生成三溴酚类沉淀)
⑤.含醛基的化合物
1、SO2能作漂白剂。SO2虽然能漂白一般的有机物,但不能漂白指示剂如石蕊试液。SO2使品红褪色是因为漂白作用,SO2使溴水、高锰酸钾褪色是因为还原性,SO2使含酚酞的NaOH溶液褪色是因为溶于不生成酸。
2、SO2与Cl2通入水中虽然都有漂白性,但将二者以等物质的量混合后再通入水中则会失去漂白性,
3、 往某溶液中逐滴加入稀盐酸,出现浑浊的物质:
第一种可能为与Cl- 生成难溶物。包括:①AgNO3
第二种可能为与H+反应生成难溶物。包括:
① 可溶性硅酸盐(SiO32-),离子方程式为:SiO32-+2H+=H2SiO3↓
② 苯酚钠溶液加盐酸生成苯酚浑浊液。
③ S2O32- 离子方程式:S2O32- +2H+=S↓+SO2↑+H2O
④ 一些胶体如Fe(OH)3(先是由于Fe(OH)3的胶粒带负电荷与加入的H+发生电荷中和使胶体凝聚,当然,若继续滴加盐酸至过量,该沉淀则会溶解。)若加HI溶液,最终会氧化得到I2。
⑤ AlO2- 离子方程式:AlO2- +H+ +H2O==Al(OH)3当然,若继续滴加盐酸至过量,该沉淀则会溶解。
4、浓硫酸的作用:
①浓硫酸与Cu反应--强氧化性、酸性 ②实验室制取乙烯--催化性、脱水性
③实验室制取硝基苯--催化剂、吸水剂 ④酯化反应--催化剂、吸水剂
⑤蔗糖中倒入浓硫酸--脱水性、强氧化性、吸水性
⑥胆矾中加浓硫酸-- 吸水性
5、能发生银镜反应的有机物不一定是醛.可能是:
①醛;②甲酸;③甲酸盐;④甲酸酯;⑤葡萄糖;⑥麦芽糖(均在碱性环境下进行)
6、既能与酸又能与碱反应的物质
① 显两性的物质:Al、Al2O3、Al(OH)3
② 弱酸的铵盐:(NH4)2CO3、(NH4)2SO3、(NH4)2S 等。
③ 弱酸的酸式盐:NaHS、NaHCO3、NaHSO3等。
④ 氨基酸。
⑤ 若题目不指定强碱是NaOH,则用Ba(OH)2, Na2CO3、Na2SO3也可以。
7、有毒的气体:F2、HF、Cl2、H2S、SO2、CO、NO2、NO、Br2(g)、HCN。
8、常温下不能共存的气体:H2S和SO2、H2S和Cl2、HI和Cl2、NH3和HCl、NO和O2、F2和H2。
9、其水溶液呈酸性的气体:HF、HCl、HBr、HI、H2S、SO2、CO2、NO2、Br2(g)。
10、可使湿润的红色石蕊试纸变蓝的气体:NH3。有漂白作用的气体:Cl2(有水时)和SO2,但两者同时使用时漂白效果减弱。检验Cl2常用淀粉碘化钾试纸,Cl2能使湿润的紫色石蕊试纸先变红后褪色。
11、能使澄清石灰水变浑浊的气体:CO2和SO2,但通入过量气体时沉淀又消失,鉴别用品红。
12、具有强氧化性的气体:F2、Cl2、Br2(g)、NO2、O2、O3;具有强或较强还原性的气体:H2S、H2、CO、NH3、HI、HBr、HCl、NO,但其中H2、CO、HCl、NO、SO2能用浓硫酸干燥;SO2和N2既具有氧化性又具有还原性,。
13、与水可反应的气体:Cl2、F2、NO2、Br2(g)、CO2、SO2、NH3;其中Cl2、NO2、Br2(g)与水的反应属于氧化还原反应(而且都是歧化反应),只有F2与水剧烈反应产生O2。
14、能使湿润的淀粉碘化钾试纸变蓝的气体:Cl2、NO2、Br2(g)、O3。
15、能使溴水和酸性高锰酸钾溶液褪色的气体:H2S、SO2、C2H4、C2H2、其它不饱和有机气体。
16、可导致酸雨的主要气体:SO2;NO2。导致光化学烟雾的主要气体:NO2等氮氧化物和烃类;
导致臭氧空洞的主要气体:氟氯烃(俗称氟利昂)和NO等氮氧化物;
导致温室效应的主要气体:CO2和CH4等烃;
能与血红蛋白结合导致人体缺氧的气体是:CO和NO。
17、可用作致冷剂或冷冻剂的气体:CO2、NH3、N2。
18、用作大棚植物气肥的气体:CO2。
19、被称做地球保护伞的气体:O3。
20、用做自来水消毒的气体:Cl2
21、不能用CaCO3与稀硫酸反应制取CO2,应用稀盐酸。
22、实验室制氯气用浓盐酸,稀盐酸不反应;Cu与浓硫酸反应,与稀硫酸不反应;苯酚与浓溴水反应,稀溴水不反应。
23、有单质参与或生成的反应不一定是氧化还原反应。比如同素异形体之间的转变。
24、能与酸反应的金属氧化物不一定是碱性氧化物。如Al2O3、Na2O2。
25、单质的还原性越弱,则其阳离子的氧化性不一定越强 ,如Cu的还原性弱于铁的,而Cu2+的氧化性同样弱于Fe3+ 。
26、中学常见的卤族元素与水反应 不一定符合:X2+H2O=HX+HXO类型。F2与水反应方程式应是: 2F2+2H2O=4HF+O2↑
27、AgF,AgCl,AgBr,AgI见光一定分解,有感光性。不一定:AgF稳定,见光不分解。
28、卤族元素在化合物中一定既能是负价也能显正价。不一定,F在化合物中只能显负价,不显正价。
29、卤素的无氧酸一定都是强酸。不一定,氢氟酸却为弱酸。
30、卤素单质和铁反应的生成物一定都是FeX3。不一定:I2与铁反应只生成FeI2。
31、酸式盐的水溶液一定显酸性。不一定:NaHS、NaHCO3是酸式盐,但它的水溶液显碱性,NaH2PO4、NaHSO4溶液显酸性。
32、一般地说,排在金属活动性顺序表氢前面的金属一定能从酸中置换出氢。不一定:这是指稀酸和非氧化性的酸,否则不能置换出氢,如Mg与HNO3或浓H2SO4反应都不放出氢气,因为氢很快被氧化成水。另外,冷的浓硫酸或浓HNO3能使铁、铝钝化。
33、酸与酸一定不发生反应。不一定:强氧化性的酸(如浓H2SO4)与强还原性的酸(如氢硫酸)可以发生氧化还原反应: H2S+H2SO4(浓)=SO2↑+S↓+2H2O
34、碱与碱一定不发生反应。不一定:具有两性的Al(OH)3与NaOH溶液可以发生反应。
35、 H++OH-=H2O能表示强酸强碱中和反应的离子方程式:。不一定:氢氧化钡和硫酸的反应的离子方程式应写为: Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,酸式盐和强碱反应的离子方程式也可以写成以上离子反应方程式,例NaHSO4+NaOH=Na2SO4+H2O的反应。
36、按金属活动性顺序,排在前面的金属一定能将排在后面的金属从其盐溶液中置换出来。不一定:如钠与硫酸铜溶液反应,是钠先跟溶液中的水反应生成氢氧化钠,然后氢氧化钠再和硫酸铜反应。
37、阴离子一定只具有还原性。不一定:Na2O2中的过氧根离子、ClO- 既有氧化性又有还原性:NO3-,MnO4-,ClO4-等阴离子在酸性条件下都具有氧化性。
38、阳离子不一定只具有氧化性。Fe2+就具有还原性。含有最高价元素的化合物不一定具有强氧化性 ,如较稀的H2SO4。
39、盐与碱一般发生复分解反应,一定生成新盐和新碱。不一定:酸式盐与碱反应一般生成正盐和水。如:NaHCO3+NaOH=Na2CO3↓+H2O
40、质子总数相同,核外电子总数也相同的分子不一定是同一种分子。Ne与HF符合上述要求,但它们并不是同一种分子。
41、金属与盐溶液的反应一定发生的是置换反应。不一定:铁跟三氯化铁溶液,铜跟三氯化铁溶液的反应为: 2FeCl3+Fe=3FeCl2 Cu+2FeCl3=CuCl2+2FeCl2
42、强电解质在离子方程式中都一定要写成离子的形式。不一定:CaCO3,BaSO3为难溶强电解质,但在离子方程式中仍写成分子的形式
43、强电解质溶液的导电性一定比弱电解质溶液的导电性强。不一定:要看离子浓度大小。
44、N2(气)+3H2(气)=2NH3(气)为可逆反应,达到平衡后向密闭容器中充入稀有气体(此气体不参加反应),密闭容器内的压强必然增大,平衡一定向正反应方向进行。不一定:体积不变时,平衡不移动,体积可变时,平衡向气体系数和大的方向(逆)移动。
45、单质气体一定都是由双原子组成的分子。不一定:稀有气体为单原子分子,臭氧(O3)为三原子分子。
46、醇类经缓慢氧化一定生成醛。不一定:醛还可以继续被氧化成酸。
47、醇一定能氧化成醛。不一定:羟基不在碳链端点的醇,则不能氧化成醛,更不能氧化成酸。
48、化学性质相似的物质不一定是同系物。乙烯、乙炔都可以使酸性高锰酸钾溶液退色,但不是同系物。
49、凡是叫“酸”的都一定是酸类物质。不一定:石炭酸叫“酸”,但它不属于有机酸类,而属于酚类。
50、一般弱酸盐,除它们的钾、钠、铵盐外都一定不溶于水。不一定:有机物醋酸盐一般都溶于水。
51、如果烃中各元素的质量分数相同,则一定是同一种烃。不一定:乙炔和苯不是同一种烃。
52、凡是具有固定组成的有机物都一定是分子晶体、非电解质。不一定:比如乙酸钠是离子晶体。
53、电离时只能电离出唯一的阳离子H+的化合物一定能使指示剂变色。不一定:水、苯酚都符合上述要求,但它们都不能使指示剂变色。
54、离子的核外都一定有电子。不一定:H+的核外没有电子。
55、在电化腐蚀时,活动性较强的金属一定先遭受到腐蚀。不一定:也有例外,如铝铁合金,往往是铁先遭受腐蚀,这是因为铝表面有Al2O3簿膜起了保护作用的结果。
56、 二氧化硅是酸性氧化物,它不溶于水与一般酸溶液(SiO2能溶于氢氟酸),但能与碱反应。
57、 用1molAl与足量NaOH溶液或足量盐酸反应,均有3mol电子发生转移 。
58、
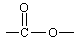
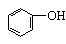 与氢气加成的:苯环结构(1:3)、碳碳双键、碳碳叁键 、醛基。酸、酯中的碳氧双键不与氢气加成。
与氢气加成的:苯环结构(1:3)、碳碳双键、碳碳叁键 、醛基。酸、酯中的碳氧双键不与氢气加成。
59、 能与NaOH反应的:-COOH、 、 、-X。
60、 能与NaHCO3反应的:-COOH
61、
 能与Na反应的:-COOH、
、-OH
能与Na反应的:-COOH、
、-OH
62、 能发生加聚反应的物质:烯烃、二烯烃、乙炔、苯乙烯、烯烃和二烯烃的衍生物。
63、 能发生银镜反应的物质:凡是分子中有醛基(-CHO)的物质均能发生银镜反应。
(1) 所有的醛(R-CHO);
(2) 甲酸、甲酸盐、甲酸某酯;
注:能和新制Cu(OH)2反应的--除以上物质外,还有酸性较强的酸(如甲酸、乙酸、丙酸、盐酸、硫酸、氢氟酸等),发生中和反应。
64、 能与溴水反应而使溴水褪色或变色的物质
80、同分异构体
通式符合CnH2nO2的有机物可能是羧酸、酯、羟基醛
通式符合CnH2n-2的有机物可能是二烯烃、炔烃
79、可逆反应按反应的系数比加入起始量,则反应过程中每种反应物的转化率均相等。
78、增大反应物A的浓度,那么A的转化率不一定降低。对于有多种反应物参加反应的可逆反应,增加A的量,A的转化率一定降低;但对于反应:2NO2 (气)== N2O4(气)当它在固定容积的密闭容器中反应时,若增大NO2的浓度时,因体系内压强增大,从而时平衡向着气体体积减小的方向移动,及平衡向右移动。那么此时NO2的转化率不是减小,而是增大了。
76、优先鉴别原理
鉴别多种物质时:先用物理方法(看颜色,观状态,闻气味,观察溶解性),再用化学方法:固体物质一般先溶解配成溶液,再鉴别;用试纸鉴别气体要先润湿试纸。
75.优先挥发原理
当蒸发沸点不同的物质的混合物时:低沸点的物质优先挥发(有时亦可形成共沸物)。
将100克36%的盐酸蒸发掉10克水后关于盐酸浓度变小,因为HCl的沸点比水低,当水被蒸发时,HCl已蒸发掉了。石油的分馏,先挥发出来的是沸点最低的汽油,其次是煤油、柴油、润滑油等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com