
16.(8分)以氯化钾和钛白厂的副产品硫酸业铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
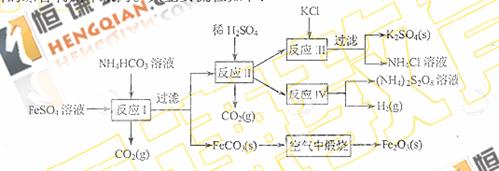
(1) 反应I前需在FeSO4溶液中加入_____▲_____(填字母),以除去溶液中的Fe3+。
A.锌粉 B.铁屑 C.KI溶液 D.H2
(2)反应Ⅰ需控制反应温度低于35℃,其目的是 ▲ 。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是 ▲ 。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为 ▲ 。
15.(10分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:

(1) 除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是_____▲_____。
(2) 酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③_____▲_____。
(3) 测定样品中Cl-含量的方法是:a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
① 上述测定过程中需用溶液润洗的仪器有_____▲_____。
②计算上述样品中CaCl2·2H2O的质量分数为_____▲_____。
② 若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有_____▲_____;_____▲_____。
14. I2在KI溶液中存在下列平衡:
I2在KI溶液中存在下列平衡:
I2(aq)+I-(aq)
 I3-(aq)
I3-(aq)
某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
A.
反应I2(aq)+I-(aq)===I3-(aq)的 H>0
H>0
B. 若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C. 若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
非选择题
13.下列溶液中微粒的物质的量浓度关系正确的是
A.室温下,向0.01 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)>c(SO2-4)>c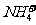
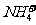 >c(OH-)=c(H+)
>c(OH-)=c(H+)
B.0.1 mol·L-1NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+)
C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
D.25℃时,pH=4.75、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液:
c(CH3COO-)+c(OH-)<c(CH3COOH)+C(H+)
12.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是
A.
 该电池能够在高温下工作
该电池能够在高温下工作
B. 电池的负极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+
C. 放电过程中,H+从正极区向负极区迁移
D.
在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体
11.下列离子方程式与所述事实相符且正确的是
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HclO+HCO-3
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl- Mn2++C
Mn2++C
C.向NaAlO2溶液中通入过量CO2制Al(OH)3
 ↓HCO-3
↓HCO-3
E. 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4;
10.具有显著抗癌活性的10-羟基喜树碱的结构如图所示。下列关于10-羟基吉树碱的说法正确的是
A.分子式为C20H16N3O5
 B.不能与FeCl3溶液发生显色反应
B.不能与FeCl3溶液发生显色反应
C.不能发生酯化反应
D.一定条件下,1 mol该物质最多可与1 mol NaOH反应
9.下列化学实验事实及其解释都正确的是
A. 向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
B. 向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
C. 向0.1 mol·L-1FeSO4溶液中滴加少量酸性KmnO4溶液,KmnO4溶液褪色,说明Fe2+具有氧化性
D. 向2.0 mL浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Kap比AgI的Kap大
8.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子是外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A. 元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B. 元素X不能与元素Y形成化合物X2Y2
C. 元素Y、R分别与元素X形成的倾听合物的热稳定性:XmY>XmR
D. 元素W、R的最高价氧化物的水化物都是强酸
不定式选择题:本题包括6小题,每小题4分,共计24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
7.在下列各溶液中,离子一定能大量共存的是
A.强碱性溶液中:K+、、Al3+、Cl-、SO2-4
B.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、NO-3
C.含有0.1 mol·L-1Ca2+的溶液中:Na+、K+、CO2-3、Cl-
E. 室温下,Ph=1的溶液中:Na+、Fe3+、NO-3、SO2-4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com