
4、13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtW ü thrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是( )
A、13C与15N有相同的中子数 B、13C与C60互为同素异形体
C、15N与14N互为同位素 D、15N的核外电子数与中子数相同
3、据报道,月球上有大量3He存在, 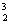 He可以作为核聚变材料。下列关于
He可以作为核聚变材料。下列关于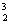 He的叙述正确的是(
)
He的叙述正确的是(
)
A、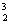 He和
He和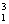 H互为同位素
B、比4He少一个质子
H互为同位素
B、比4He少一个质子
C、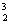 He原子核外电子数为2 D、
He原子核外电子数为2 D、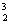 He原子核内有2个质子和3个中子
He原子核内有2个质子和3个中子
2、据报道,某些建筑材料会产生放射性同位素氡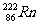 ,从而对人体产生伤害,该同位
,从而对人体产生伤害,该同位
素原子的中子数和质子数之差是( ) A、136 B、50 C、86 D、222
1、分析发现,某陨石中含有半衰期极短的镁的一种放射性同位素28Mg,该同位素的原子核内的中子数是( )A、12 B、14 C、16 D、18
12、盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe203(s)+3CO(g)=2Fe(s)+3C02(g) △H=-24.8kJ/mol
Fe203(s)+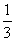 CO(g)==
CO(g)== 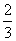 Fe3O4(s)+
Fe3O4(s)+ 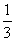 C02(g)
△H=-15.73kJ/mol
C02(g)
△H=-15.73kJ/mol
Fe304(s)+CO(g)==3FeO(s)+C02(g) △H=+640.4kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
高考化学热点知识训练9 物质结构知识
11、(1)1g碳与适量水蒸气反应生成一氧化碳和氢气,需吸收10.94KJ热量,此反应的热化学方程式为__________________________________________。
(2)奥运会圣火燃料中成份之一是丙烷,标准状况下4.48L丙烷完全燃烧生成二氧化碳和液态水时放出150.1 kJ的热量,则丙烷燃烧的热化学方程式中为____________________。
(3)家用液化气中的主要成分之一是丁烷,当10 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧反应的热化学方程式 。已知1 mol液态水汽化时需要吸收44 kJ的热量,则1 mol丁烷完全燃烧并生成气态水时放出的热量为 kJ。
10.已知两个热化学方程式: C(s)+O2(g)==CO2(g) △H= ―393.5kJ/mol
2H2(g)+O2(g)==2H2O(g) △H= ―483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是( )A.1:1 B.1:2 C.2:3 D.3:2
9.已知热化学方程式:2SO2(g)+ O2(g) 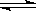 2SO3(g) △H = ―196.64kJ/mol,在容器
2SO3(g) △H = ―196.64kJ/mol,在容器
中充入8molSO2和1molO2充分反应,最终放出的热量为 ( )
A.196.64kJ B.<98.32kJ/mol C.<196.64kJ D.>196.64kJ
8.氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) △H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-89.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最多的是( )
A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)
7、已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H = ―Q1 KJ/mol
2H2(g)+O2(g)==2H2O(g) △H = ―Q2 KJ/mol
2H2(g)+O2(g)==2H2O(1) △H = ―Q3KJ/mol
常温下,取体积比为2:3的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为多少kJ( )
A.0.2Q1+0.15Q3 B.0.4Q1+0.05Q2 C.0.4Q1+0.1Q3 D.0.4Q1+0.1Q2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com