
18. (10分,每空2分)(1) H20 > NH3 > CH4 (2) H202 (3)
(4)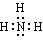 (5)NH4HCO3 碳酸氢铵
(5)NH4HCO3 碳酸氢铵
17. (5分,每个1分)
(5分,每个1分)
(1) 2H2O2 2 H2O + O2↑ (2) Fe + 2H+=Fe2++H2↑
(3) OH - + CO2 = HCO3- (4)Al2O3 + 2NaOH = 2NaAlO2 + H2O
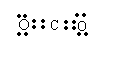 (5)
(5) 

21. (1)①
;
 ②在右图画出
②在右图画出
③ 。
④
(2) ① 。
② ; 。
贺州高级中学2009-2010学年度下学期第一次月考答案
高一化学(理)
1-5 A、C、B、D、D 6-10 B、C、D、C、C 11-16 D、B、A、A、B、D (每小题3分)
20. (1) ,理由是
(1) ,理由是
(2) ,理由是
(3) ; ;理由是

19. (1)
(1)
(2) ;
(3) (4)
(5)
18. (1) > > (2) 。
(3) 。(4) 。
(5)
17. (1)
(1)
(2)
(3)
(4)
(5)

21.(14分)某化学兴趣小组为探究铜跟硫酸的反应情况,设计了如图所示装置进行有关实验。
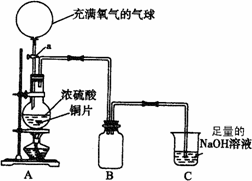 (1)先关闭活塞a,将6.4g铜片和12 mL某浓度的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
(1)先关闭活塞a,将6.4g铜片和12 mL某浓度的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中烧瓶内发生的化学方程式:
;
②B是用来收集实验中产生的气体的装置,但导管未画全,请在上图中把导管补充完整;
③实验结束后,装置C中的溶液中可能含有的溶质有 。
④铜片完全消失后,硫酸仍有剩余,乙同学欲测定余酸的物质的量浓度(假设反应前后溶液体积变化忽略不计)。他向反应后溶液中加入含溶质a mol的NaOH溶液刚好使溶液中Cu2+全部沉淀。据此,他能求出余酸的物质的量浓度吗?若能,请写出余酸物质的量浓度的计算式(用含a的代数式表达),若不能,请说明理由。
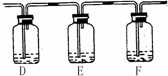 (2)该小组甲同学对“木炭与浓硫酸的反应”这个实验感兴趣,他将A中铜片换作木炭粉,并在A、B之间连接了如下装置用于检验反应产生了SO2和CO2。
(2)该小组甲同学对“木炭与浓硫酸的反应”这个实验感兴趣,他将A中铜片换作木炭粉,并在A、B之间连接了如下装置用于检验反应产生了SO2和CO2。
提供试剂:a. NaOH溶液 b. 品红溶液
c. 酸性KMnO4溶液 d. Ba(OH)2溶液
请回答:
①该同学的实验装置A中发生反应的化学方程式 。
②若要达到此目的,可以在E中加入 ;F中加入 。(填所提供试剂编号)
贺州高级中学2009-2010学年度下学期第一次月考答题卡
高一化学(理)
1-16题为选择题
20.(10分)由Cl-、Br-、CO32-、SO32-、SO42-、Na+中若干种离子组成的化合物溶于水后得无色溶液,然后依次进行实验,观察到的现象记录如下:
①向溶液中加入足量氯水,无气体产生,再加入CCl4振荡,静置,CCl4层呈橙红色,用分液漏斗分液。
②向分液后所得的水溶液中加入Ba(NO3)2和HNO3(有强氧化性)的混合溶液,有白色沉淀产生,过滤。
③在滤液中加入AgNO3和HNO3的混合液,有白色沉淀产生。
请认真分析后回答下列问题:
(1)原溶液中是否含有Na+ ,理由是
(2)原溶液中是否含有Cl-: ,理由是
(3)原溶液中是否含有SO32-、SO42-: 。如果将步骤②改为加入BaCl2和盐酸的混合液,对此判断有无影响 (填“有影响”或“无影响”),理由是 。
19.(13分)下表所列的是七种短周期元素原子的半径及主要化合价。
|
元素代号 |
A |
B |
C |
D |
E |
F |
G |
|
原子半径/nm |
0.089 |
0.071 |
0.117 |
0.16 |
0.074 |
0.082 |
0.099 |
|
主要化合价 |
+2 |
-1 |
+4,-4 |
+2 |
-2 |
+3 |
-1 |
 (1)在下列空白周期表中用斜线( )标出第VIA元素,用代号标出A、B、C 在周期表中对应的位置。
(1)在下列空白周期表中用斜线( )标出第VIA元素,用代号标出A、B、C 在周期表中对应的位置。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2)E和B非金属性较强的是 (填元素名称)
用一个置换反应证实这一结论;
(3)B、D、E所代表元素的离子半径从大到小的顺序为 (用离子符号表示)
(4)元素H在周期表中的位置如上图(空白周期表中)所示,H的元素符号和名称为
(5)I是与E同族的另一短周期元素。I的一种氧化物能与E的单质反应生成I的另一种氧化物,写出该反应的化学方程式:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com