
4.人们常说“墙内开花墙外香”,这句话的科学本意揭示了 ( )
A.分子间有间隙 B.分子的质量和体积都很小
C.分子总是在不断运动着 D.分子是保持物质化学性质的最小粒子
3.下列能源在使用的过程中,可能会形成酸雨的是 ( )
A.煤 B.风能
C.潮汐能 D.太阳能
2.下列物质中,不属于氧化物的是 ( )
A.水 B.干冰
C.氧气 D.氧化汞
1.下列过程中,主要依靠化学变化实现的是 ( )
A.牛奶变酸 B.气球爆炸
C.汽油挥发 D.西瓜榨汁
(三)当氢气停止燃烧后,取出导管,同学们进行了分组探究实验。A组同学发现制氢气后的试管中还有较多固体剩余,同学们将足量氯气通入试管中,发现固体全部消失,但未观察到有气泡产生,请解释可能原因(用离子方程式表示); ;B组同学向集气瓶中注入适量水,用力振荡后,向中满入少量Na2SO3溶液,发现溶液中没有出现黄色沉淀,但再向溶液中滴入稀盐酸酸化的氯化钡溶液后,生成了白色沉淀。[已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O],同学们分析是由于集气瓶中还有少量氯气残留的缘故。可以解释该实验现象的两个离子方程式是:
① ②
30.(16分)角膜接触镜,俗称隐形眼镜,目前最常用的是由聚甲基丙烯酸羟乙酶(HEMA)制成的中心厚度为0.05mm的超薄镜片。聚合物链节中含有的烃基是吸附性很强的极性基团,也是活泼基团,赋予聚合物良好的亲水性。HEMA可以由烃经以下列途径合成。
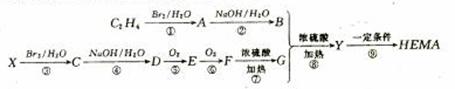
(1)X的结构简式是 ;B的名称是 ;
(2)写出G中所含官能团的结构简式 ;
(3)写出下列反应的反应类型③ ⑥
(4)写出下列反应的化学方程式
① ②
(5)E有多种同分异构体,请写出满足下列条件的同分异构体的结构简式Ⅰ:不能发生银镜反应,Ⅱ:一定条件下能够与氢氧化钠溶液反应但不能与碳酸钠溶液反应,Ⅲ:分子中含有两个甲基:
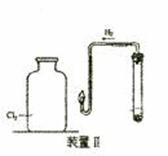
(二)在上图所示装置Ⅱ中,在试管中先加入过量铁粉,再滴入少量CaSO4溶液,最后加入一定量稀盐酸,塞上胶塞,观察到有大量气泡产生。
①检查制取氢气装置气密性的操作方法是
②当点燃氢后,将导管伸入盛有氯气的集气瓶中,观察到的现象是
6.下列有关元素化合物的叙述中正确的是 ( )
A.碱金属原子的最外层电子数都是1,次外层电子数都是8
B.将SO2通入滴有紫色石蕊试液的水中,溶液变成红色
C.白磷易溶于水,不能保存在水中
D.高性能通信材料光 导纤维的主要原料是单品硅
7.下列离子方程式书写正确的是 ( )
A.向苯酚钠溶液中通入少量CO2;C3H2O-+CO2+H2O→C6H8OH+HCO3-
B.铝片溶于NaOH溶液:Al+2OH-=AlO2+H2↑
C.向1mol碘化亚铁的溶液中通入标准状况下22.4L氧气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.Fe3O4溶于稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
8.美国罗氏生产的奥司他韦磷酸盐胶囊剂(商品名中国大陆称达菲·港译特敏福,台湾译为克流感)是市场上唯一的奥司他韦制剂。2009的,由于甲型H1N1在世界范围的扩散,全球掀起一般抢购达菲原风潮。奥司他韦的结构如图;下列说法正确的是( )
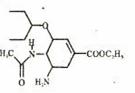 A.奥司他志是一种芳香族化合物,分子式为C18H28O4N3
A.奥司他志是一种芳香族化合物,分子式为C18H28O4N3
B.1mol该化合物可以和3mol氢气发生加成反应
C.该化合物能发生水解反应,加成反应、氧化反应和消去反应
D.奥司他韦可以和磷酸在一定条件下制取奥司他韦磷酸盐是
由于具有碱性基团氨基
9.在一个体积可变的密闭容器中,通入2molHI气体,在一定条件下建立如下平衡:
 2H1(g) I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是 ( )
2H1(g) I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是 ( )
A.保持容器体积不变,升高温度,混合气体的颜色逐渐变浅
B.保持容器体积与温度不变,充入一定量氦气(不参与反应),则正反应速率和逆反应速率均增大
C.保持温度不变,缓慢压缩容器,使容器体积恒定为0.2L,一定时间后,测得c(I2)=25mol/L
 D.保持容器压强和温度不变,再通入2molHI气体,到达平衡状态后,测得HI的转化率为60%
D.保持容器压强和温度不变,再通入2molHI气体,到达平衡状态后,测得HI的转化率为60%
10.化学实验小组在学习化学电源和氯碱工业相关知识后,在实
验室
进行实验验证,他们设计组装了如下图所示装置,已知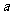
为石墨电极;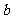 为铁电极;
为铁电极;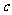 为铝电极(已除去表面氧化膜);
为铝电极(已除去表面氧化膜);
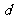 为多孔石墨电极,烧杯中是足量饱和食盐水(滴有酚酞),连好
为多孔石墨电极,烧杯中是足量饱和食盐水(滴有酚酞),连好
导线后,电流计指针发生明显偏转。下列判断正确的是( )
A.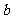 为负极,
为负极,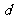 为阳极
为阳极
B.一段时间后,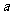 和
和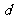 电极附近溶液变红
电极附近溶液变红
C.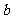 电极电极反应式为:2Cl-2e-=Cl2↑
电极电极反应式为:2Cl-2e-=Cl2↑
D.当电解一段时间,B中出现大量白色沉淀时,停止实验,再将A中溶液倒入B中混合,充分振荡,沉淀全部消失
11.在化学实验操作中,往往由于读数不规范导致较大的实验误差。下列有关实验中,会导致所配制(或所测定)溶液浓度偏大的是(其他操作均正确)
A.配制500mL 1mol/L稀硫酸实验中,用量筒量取181mol /L浓硫酸时俯视读数
B.配制1mL 51mol/L氯化钠溶液实验中,定容时仰视
C.用标准盐酸滴定特测NaOH溶液实验中,使用碱式滴定管开始平视,后来俯视读数
D.用标准NaOH溶液滴定特测盐酸实验中,使用碱式滴定管开始平视,后来俯视读数
12.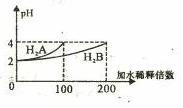 常温下,取pH=2 的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是 ( )
常温下,取pH=2 的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是 ( )
A.H2A为二元弱酸
B.稀释前c(H2B)>c(H2A)=0.01mol /L
C.pH=3的NaHA水溶液中,离子浓度大小为
c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
D.Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+)
13.CO2与H2的混合气体5g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4g,则原混合气体中CO2的物质的量分数为 ( )
A.25% B.75% C.88% D.32%
第Ⅱ卷(非选择题)
27.(14分)有A、B、C、D、E、F六种主族元素,原子序数均不大于20,且原子序数依次递增。其中A与E、D与F同主族。已知A和C的核外电子数加和与E的核电荷数相同。B与C可形成两种以上的气态化合物。A与F、C与E均可形成化学式为XY2型的化合物。
(1)B元素的常见简单氢化物的空间构型是 ;C与E形成的XY2型的化合物的晶体属于 (填晶体类型),工业上从该化合物中提取E单质粗产品的方程式为 ;
(2)A与F形成的XY2型化合物的电子式为 ,该物质遇水剧烈反应反应生成一种可燃性气体,该气体的燃烧热为1306KJ/mol,请写出表示燃烧热的热化学方程式 。
(3)将D元素的单质溶于浓度很稀的B的最高价氧化物的水化物,反应中未收集到任何气体,则该反应的离子方程式为 。
28.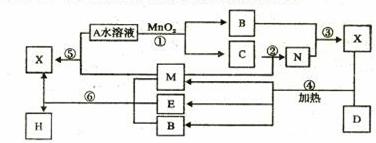 (15分)已知化合物A与B,M与N的元素组成相同,且四种物质中含有同一种元素,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
(15分)已知化合物A与B,M与N的元素组成相同,且四种物质中含有同一种元素,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
(1)A的结构式 ,E的化学式为 ;
(2)在①至⑥的化学反应中,属于氧化还原反应的化合反应为 (填序号)
(3)写出下列反应的化学方程式② ④
(4)将含有1.2molH的水溶液调节至中性, 通入足量C充分反应,生成红褐色沉淀且溶液呈黄色,经过滤、洗涤、灼烧至恒重,称量所得固体的质量为 。
29.(15分)化学实验兴趣小组在实验室 进行氢气在氯气中的燃烧实验。
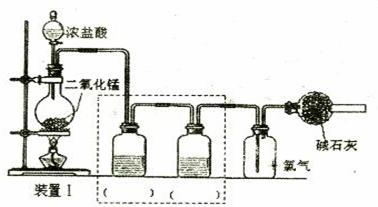 (一)设计如下图所示装置I制备和收焦干燥纯净的氯气以备后续实验;
(一)设计如下图所示装置I制备和收焦干燥纯净的氯气以备后续实验;
烧瓶中发生反应的离子方程式为 ;请根据实验目的将装置I中虚线框内装置补充完整并在括号内注明所需试剂;
14. 某单位建造一间地面面积为12m2的背面靠墙的矩形小房,由于地理位置的限制,房子侧面的长度x不得超过a米,房屋正面的造价为400元/m2,房屋侧面的造价为150元/m2,屋顶和地面的造价费用合计为5800元,如果墙高为3m,且不计房屋背面的费用.
(1)把房屋总造价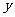 表示成
表示成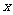 的函数,并写出该函数的定义域.
的函数,并写出该函数的定义域.
(2)当侧面的长度为多少时,总造价最底?最低总造价是多少?
13. 为保增长、促发展,某地计划投资甲、乙两项目,市场调研得知,甲项目每投资100万元需要配套电能2万千瓦,可提供就业岗位24个,增加 260万元;乙项目每投资100万元需要配套电能4万千瓦,可提供就业岗位36个,增加
260万元;乙项目每投资100万元需要配套电能4万千瓦,可提供就业岗位36个,增加 200万元.已知该地为甲、乙两项目最多可投资2500万元,配套电能100万千瓦,并要求它们提供的就业岗位不少于840个.如何安排甲、乙两项目的投资额,增加的
200万元.已知该地为甲、乙两项目最多可投资2500万元,配套电能100万千瓦,并要求它们提供的就业岗位不少于840个.如何安排甲、乙两项目的投资额,增加的 最大?
最大?
12.若奇函数f(x)在定义域(-1,1)上是减函数.
⑴求满足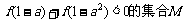
⑵对⑴中的a,求函数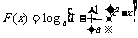 的定义域。
的定义域。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com