
6.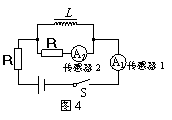 图4是用电流传感器(相当于电流表,其电阻可以忽略不计)研究自感现象的实验电路,图中两个电阻的阻值均为R,L是一个自感系数足够大的自感线圈,其直流电阻值也为R。图5是某同学画出的在t0时刻开关S切换前后,通过传感器的电流随时间变化的图像。关于这些图像,下列说法中正确的是( )
图4是用电流传感器(相当于电流表,其电阻可以忽略不计)研究自感现象的实验电路,图中两个电阻的阻值均为R,L是一个自感系数足够大的自感线圈,其直流电阻值也为R。图5是某同学画出的在t0时刻开关S切换前后,通过传感器的电流随时间变化的图像。关于这些图像,下列说法中正确的是( )
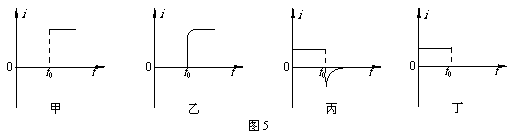
A.甲图是开关S由断开变为闭合,通过传感器1的电流随时间变化的情况
B.乙图是开关S由断开变为闭合,通过传感器1的电流随时间变化的情况
C.丙图是开关S由闭合变为断开,通过传感器2的电流随时间变化的情况
D.丁图是开关S由闭合变为断开,通过传感器2的电流随时间变化的情况
5.一个微型吸尘器的直流电动机的额定电压为U,额定电流为I,线圈电阻为R,将它接在电动势为E,内阻为r的直流电源的两极间,电动机恰好能正常工作,则 ( )
A.电动机消耗的总功率为UI B.电动机消耗的热功率为
C.电源的输出功率为EI D.电源的效率为1-
4.平行板电容器C与三个可变电阻器R1、R2、R3以及电源连成如图3所示的电路。闭合开关S待电路稳定后,电容器C两极板带有一定的电荷。要使电容器所带电荷量增加,以下方法中可行的是( )
A.只增大R1,其他不变 B.只增大R2,其他不变
C.只减小R3 ,其他不变 D.只减小a、b两极板间的距离,其他不变
3.
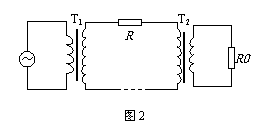 某小型水电站的电能输送示意图如图2所示,发电机通过升压变压器T1和降压变压器T2向用户供电。已知输电线的总电阻为R,降压变压器T2的原、副线圈匝数之比为4∶1,降压变压器副线圈两端交变电压u=220
某小型水电站的电能输送示意图如图2所示,发电机通过升压变压器T1和降压变压器T2向用户供电。已知输电线的总电阻为R,降压变压器T2的原、副线圈匝数之比为4∶1,降压变压器副线圈两端交变电压u=220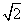 sin100πt V,降压变压器的副线圈与阻值R0=11Ω的电阻组成闭合电路。若将变压器视为理想变压器,则下列说法中正确的是(
)
sin100πt V,降压变压器的副线圈与阻值R0=11Ω的电阻组成闭合电路。若将变压器视为理想变压器,则下列说法中正确的是(
)
A.通过R0电流的有效值是20A
B.降压变压器T2原、副线圈的电压比为4:1
C.升压变压器T1的输出电压等于降压变压器T2的输入电压
D.升压变压器T1的输出功率大于降压变压器T2的输入功率 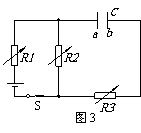
2.如图1所示,线圈两端与电阻相连构成闭合回路,在线圈上方有一竖直放置的条形磁铁,磁铁的S极朝下。在将磁铁的S极插入线圈的过程中( )
A.通过电阻的感应电流的方向由a到b,线圈与磁铁相互排斥
B.通过电阻的感应电流的方向由a到b,线圈与磁铁相互吸引
C.通过电阻的感应电流的方向由b到a,线圈与磁铁相互排斥
D.通过电阻的感应电流的方向由b到a,线圈与磁铁相互吸引
1. 使两个完全相同的金属小球(均可视为点电荷)分别带上-3Q和+5Q的电荷后,将它们固定在相距为a的两点,它们之间库仑力的大小为F1。现用绝缘工具使两小球相互接触后,再将它们固定在相距为2a的两点,它们之间库仑力的大小为F2。则F1与F2之比为( )
使两个完全相同的金属小球(均可视为点电荷)分别带上-3Q和+5Q的电荷后,将它们固定在相距为a的两点,它们之间库仑力的大小为F1。现用绝缘工具使两小球相互接触后,再将它们固定在相距为2a的两点,它们之间库仑力的大小为F2。则F1与F2之比为( )
A.2:1 B.4:1 C.16:1 D.60:1
(二)选考题
34.(15分)化学选做题
A.[物质结构与性质] 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
|
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
|
B元素原子的核外p电子数比s电子数少1 |
|
C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
|
D原子核外所有p轨道全满或半满 |
|
E元素的主族序数与周期数的差为4 |
|
F是前四周期中电负性最小的元素 |
|
G在周期表的第七列 |
(1)已知BA5 为离子化合物,写出其电子式
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形
 (3)某同学根据上述信息,推断C基态原子的核外电子排布为,
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
该同学所画的电子排布图违背了
(4)G位于 族 区,价电子排布式为
(5)DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为
(6)检验F元素的方法是 ,请用原子结构的知识解释产生此现象的原因是
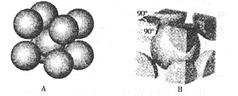
(7)F元素的晶胞如右图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,
F原子的摩尔质量为M,则F原子的半径为 cm
B.[有机化学基础] 苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。已知:
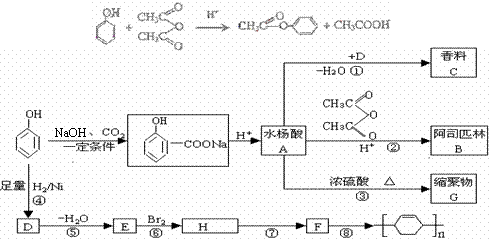
(1)写出反应类型:④_____________,A中含有官能团的名称 。
(2)写出C的结构简式________________,G的结构简式__________________。
(3)写出反应B与氢氧化钠反应的化学方程式________________________________。
(4)写出反应②的化学方程式______________________________________________。
(5)写出反应⑧的化学方程式_______________________________________。
(6)下列可检验阿司匹林样品中混有水杨酸的试剂是__________。
(a)三氯化铁溶液 (b)碳酸氢钠溶液 (c)石蕊试液
(7)保持官能团和位置不变,写出B的同分异构体有 种
(一)必考题
|
Na2SO3(s) + H2SO4(85%)==Na2SO4 + H2O + SO2↑
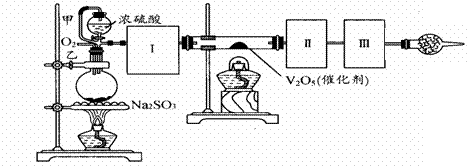
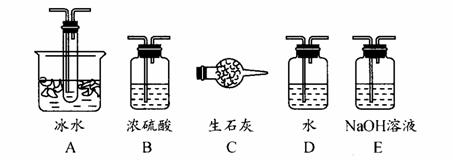
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A-E装置中选择最适合装置并将其序号填入下面的空格中。
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是 、 、 。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是 。若用大火加热烧瓶时,SO2的转化率会 (填“升高”、“不变”或“降低”)
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因并说明相应的验证方法(可以不填满)。
①原因 ,验证方法
②原因 ,验证方法
③原因 ,验证方法
(4)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式
(5)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为 %(用含a、b的代数式填写)
27.(14分)反应①②是重要的化工反应,D、E、F、G、M为单质,D、E、G、H为气体,且只有E为有色气体,G是空气中主要成分之一,F、M是生活中常见的金属,K是白色沉淀,C的焰色反应为黄色,P是M和紫黑色固体单质化合的产物,P、J、L、M含有同种元素,其物质间转化关系如下,虚框内是需设计的内容,反应物只能用A-N中的物质。请回答下列问题:
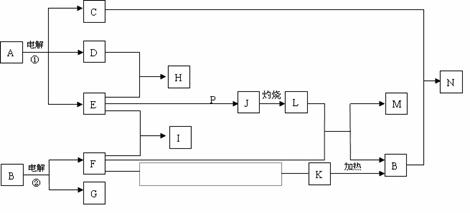
(1)用电子式表示H物质的形成过程
(2)电解池①中的阴极产物的名称
(3)足量的E与P溶液反应生成J,离子方程式为
(4)N溶液呈碱性,用离子方程式解释原因
(5)请模仿上述物质转化关系图设计F→K的最佳途径:(用A-N中的物质的化学式表示)

F - →K
按设计得到1molK,至少需要另加的试剂及其物质的量是
n( )= mol;n( )= mol。
28. (14分)可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。
(14分)可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。
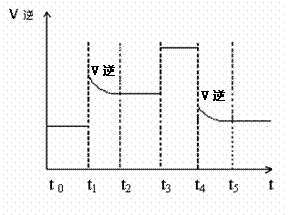
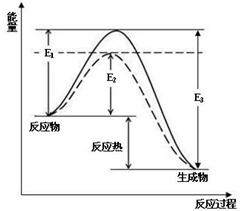
图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成氨的热化学方程式 (热量用E1、E2或E3表示)
(2) 图1中虚线部分是通过改变化学反应中的 条件,请解释原因
(3)当反应达到平衡位置时不断改变条件(不改变N2、H2和NH3的量),图2表示反应速率与反应过程的关系,其中表示平衡混合物中NH3的含量最高的一段时间是
(4)在一定温度下,若将4a mol H2和2amol N2放入2L的密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是 (“正向移动”“ 逆向移动”或“不移动”)
(5)将上述实验中产生的NH3通入到0.04mol·L-1的FeCl3溶液中,要使溶液中Fe3+沉淀较完全(即Fe3+浓度降至原来的千分之一),则溶液的pH为 (已知常温下,Fe(OH)3的溶度积常数Ksp=4×10-38)
7.化学与生产、生活、社会密切相关。下列有关说法中不正确的是 ( )
A.2009年12月在哥本哈根召开的国际气候会议受到全球政要的广泛关注。减缓工业生产大量二氧化硫的排放以抑制全球气候变暖成为该会议的主题
B.针对目前甲型H1N1流感的扩散情况,要加强对环境、个人的消毒预防。其中消毒剂常选用含氯消毒剂、酒精、双氧水等适宜的物质
C.2009年诺贝尔物理学奖授予华裔科学家高锟,是因其在光纤材料领域取得了卓越贡献。光纤的主要成分与玛瑙相同,通常情况下不与强氧化剂和强酸反应
D.建国60周年庆典晚会上,天安门广场燃放的焰火是某些金属元素魅力的展现
8.下列叙述中正确的是 ( )
A.将苯加入浓溴水中,溴水褪色,是因为发生了取代反应
B.水煤气、焦炉气、沼气、汽油等都是混合物,而高分子化合物PVC是纯净物
C.现代石油化工采用银作催化剂由乙烯制备环氧乙烷,其原子利用率为100﹪,符合化学原子经济性要求
D.除去乙酸乙酯中的少量乙酸,可用氢氧化钠溶液充分反应后再分液
9.下列物质一定有固定熔沸点的是 ( )
A.C5H10 B.CH3Cl C.C2H4Cl2 D.C2H4O2
10.下列有关实验装置及选项中的说法均正确的是 ( )
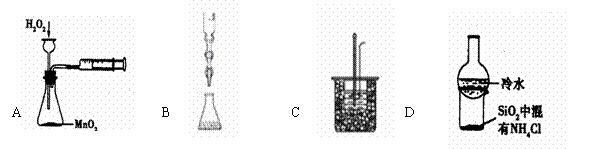 A.实验目的:定量测定化学反应速率
A.实验目的:定量测定化学反应速率
B.实验原理:利用氧化还原反应原理,用酸性高锰酸钾溶液滴定亚硫酸钠溶液,测定亚硫酸钠溶液的浓度
C.实验过程中某步骤:将0.1mol/L50mLNaOH溶液逐滴加入到0.1mol/L55mL盐酸溶液中
D.加热烧杯,分离SiO2和NH4Cl的现象:烧杯底部有白色固体出现
11.下列化学用语表示正确的是 ( )
A.硫酸氢钾加热熔融的电离方程式:KHSO4 = K+ + H+ + SO42-
B.氯化铵溶液显酸性的原因:NH4++ H2O = NH3•H2O + H+
C.铅蓄电池放电时阳极反应:Pb + SO42- - 2e-= PbSO4
D.氯化铁溶液中滴加少量的硫化钠溶液:2Fe3+ + S2- = 2Fe2+ + S↓
12.X、Y、Z、W为短周期主族元素,原子序数依次增大,X的族序数是周期数的2倍,Y的气态氢化物与最高价氧化物水化物可形成盐,Z的最外层电子数与其电子总数比为3︰8,下列说法正确的是 ( )
A.X、Y、W的最高价含氧酸酸性顺序:Y>W>X
B.Z、W可形成ZW2的化合物,属于离子化合物
C.离子半径:Z>W>Y
D.气态氢化物的稳定性:Z>W
13.下列说法正确的是 ( )
A.25℃时,pH为9的Na2CO3溶液和pH为5的NaHSO4溶液中,水的电离程度相同
B.在含有Al3+的KNO3溶液中,可通过加热的方法除去Al3+,证明盐的水解是吸热反应
C.已知HF的酸性比HCN的酸性强,则等体积等浓度NaF和NaCN两溶液中阳离子的物质的量之和相等
D.等物质的量浓度的 ① NH4Cl ② NH4HSO4 ③ Na2S ④ NaNO3 ⑤ (NH4)2SO4 ,
其pH由大到小的排列为③>④>⑤>①>②
第Ⅱ卷(非选择题)
24.(本题12分) 设抛物线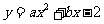 与x轴交于两个不同的点A(-1,0)、B(m,0),与y轴交于点C.且∠ACB=90°.
与x轴交于两个不同的点A(-1,0)、B(m,0),与y轴交于点C.且∠ACB=90°.
(1)求m的值;
(2)求抛物线的解析式,并验证点D(1,-3 )是否在抛物线上;
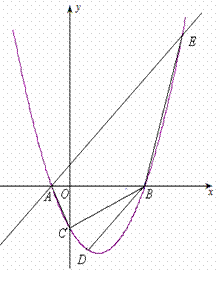 (3)已知过点A的直线
(3)已知过点A的直线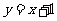 交抛物线于另一点E. 问:在x轴上是否存在点P,使以点P、B、D为顶点的三角形与△AEB相似?若存在,请求出所有符合要求的点P的坐标. 若不存在,请说明理由.
交抛物线于另一点E. 问:在x轴上是否存在点P,使以点P、B、D为顶点的三角形与△AEB相似?若存在,请求出所有符合要求的点P的坐标. 若不存在,请说明理由.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com