
1.下列对有关实验的叙述,正确的是 ( )
A.在观察洋葱细胞有丝分裂实验中,将已经解离、漂洗、染色的根尖置于载玻片上,轻轻盖上盖玻片后即可镜检
B.对酵母菌计数时,用吸管吸取培养液滴满血球计数板的计数室及其四周边缘,轻轻盖上盖玻片后即可镜检
C.在叶绿体色素提取实验中,研磨绿叶时应加一些有机溶剂,如无水乙醇等
D.检测试管中的梨汁是否有葡萄糖,可以加入适量斐林试剂后,摇匀并观察颜色变化
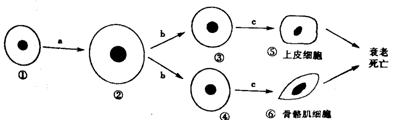 2.下图为人体细胞的分裂、分化、衰老和死亡过程的示意图,图中①~⑥为各个时期的细胞,a-c表示细胞所进行的生理过程。据图分析,下列叙述正确的是 ( )
2.下图为人体细胞的分裂、分化、衰老和死亡过程的示意图,图中①~⑥为各个时期的细胞,a-c表示细胞所进行的生理过程。据图分析,下列叙述正确的是 ( )
A.与①相比,②的表面积与体积的比值增大,与外界环境进行物质交换的能力增强
B.⑤与⑥细胞内的基因容易发生突变
C.⑤⑥细胞内遗传信息的流动方向为:DNA→RNA→蛋白质
D.细胞衰老与死亡会引起人体的衰老与死亡

29.(15分)某学习小组用题27图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(1)A中试剂为_____________________________。
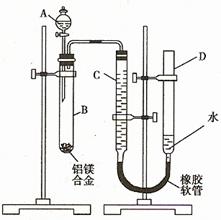 (2)实验前,先将铝镁合金在稀硝酸中浸泡片刻,其目的是除去
(2)实验前,先将铝镁合金在稀硝酸中浸泡片刻,其目的是除去
_____________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性。上述操作的顺序是_______________________________(填序号);记录C的液面位置时,除视线平视外,还应
_________________________。
(4)B中发生反应的化学方程式为_________________________________________;
(5)若实验用铝镁合金的质量为a g ,测得氢气体积为b mL (已换算为标准状况),B中剩余固体质量为c g,则铝的相对原子质量为____________________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将___________________(填“偏大”、“偏小”、“不受影响”)。
28.(16分)A、B、C、D、E、F和G都是有机化合物,它们的关系如下图所示:

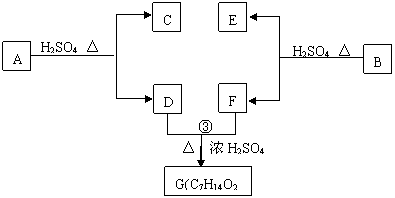

(1)化合物C的分子式是C7H8O,C遇FeCl3溶液显紫色,C苯环上的一溴代物只有两种,则C的结构简式为_______________________。
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3 反应放出CO2,则D分子式为___________,D具有的官能团是____________________。
(3)反应①的化学方程式是___________________________________________________。
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是_________________________________________。
(5)E可能的结构简式是
27.(16分)下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4︰5,化合物D是重要的工业原料。
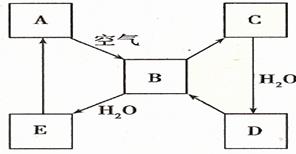
(1)写出A在加热条件下与H2反应的化学方程式_______________________________。
(2)写出E与A的氢化物反应生成A的化学方程式___________________________。
(3)写出一个由D生成B的化学方程式____________________________________。
(4)将5 mL0.10 mol·L-1的E溶液与10 mL0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式__________________________________________;
②反应后溶液的pH ____7(填“大于”、“小于”或“等于”),理由是
;
③加热反应后的溶液,其pH___ __(填“增大”、“不变”或“减小”),理由是
_ 。
26.(13分)某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I 一。为鉴定这些离子,分别取少量溶液进行以下实验:
① 测得混合液呈碱性;
② 加 HCl 后,生成无色无味气体。该气体能使饱和石灰水溶液变浑浊;
③ 加 CCl4,滴加少量氯水,振荡后, CCl4层未变色;
④ 加 BaCl2溶液产生白色沉淀,分离,在沉淀中加人足量盐酸,沉淀不能完全溶解;
⑤ 加 HNO3 酸化后,再加过量 AgNO3,溶液中析出白色沉淀。
(1)分析上述 5 个实验,写出每一实验鉴定离子的结论与理由。
实验 ① ;
实验 ② ;
实验 ③ ;
实验 ④ ;
实验 ⑤ ;
(2)上述 5 个实验不能确定是否存在的离子是 。
13.工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)=Si(s)+4HCl(g);
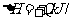 mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L.min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
12.香兰素是重要的香料之一,它可由丁香酚经多步反应合成。

有关上述两种化合物的说法正确的是
A.常温下,1 mol丁香酚只能与1 molBr2反应
B.丁香酚不能FeCl3溶液发生显色反应
C.1 mol香兰素最多能与3 mol氢气发生加成反应
D.香兰素分子中至少有12个原子共平面
11.某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
10.一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是
A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e- B.O2(g)+4H+(aq)+4e-=2H2O(1)
C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e- D.O2(g)+2H2O(1)+4e-=4OH-
9.X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是
A.由mXa+与nYb-,得m+a=n-b
B.X2-的还原性一定大于Y-
C.X,Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com