
15.(8分)汞不溶于水,易挥发,易与许多金属形成合金,汞是对人体危害较大的一种金属,据统计世界上有80多种工业以汞为原料,生产过程中产生的汞的污染越来越引起人们的重视,水体中的无机汞主要有Hg2+、Hg22+。
(1)实验时倘若不慎,将汞溅落地面时,可先用涂上X溶液的锌片去粘拾,然后再用足量的X溶液溶解锌片回收汞,X溶液可以是 ▲ (填试剂名称)。
(2)检测水体中的Hg2+可用KI及CuSO4溶液与其反应生成橙红色Cu2HgI4沉淀,用漫反射光谱直接测定汞沉淀物,该反应的离子方程式可表示为: ▲ 。
(3)冶金厂治理含汞、含硫的烟气并回收汞,中国冶金工作者在研究Hg-I-H2O系热力学的基础上,查明KI溶液能有效吸收汞,吸收总反应为:2Hg+SO2+8I一+4H+ =2HgI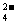 +S+2H2O,最后进行电解吸收液(K2HgI4),阴极的电极反应式为: ▲ 。
+S+2H2O,最后进行电解吸收液(K2HgI4),阴极的电极反应式为: ▲ 。
(4)国家制定的工业废水排放标准:汞的含量≤0.05 mg/L。某合作学习小组的同学拟用硫化钠法处理含汞废水,其步骤为:先将溶液pH调至8-10,然后加入稍过量的硫化钠溶液,最后加入一定量的FeSO4溶液,过滤后排放。已知:25℃HgS的Ksp= 4×10-52;Hg2S的Ksp=1.0×10-47,FeS 的Ksp=6.3×10-18;HgS+Na2S Na2HgS2(易溶)。
Na2HgS2(易溶)。
①若操作程序完全正确,且废水中只含无机汞,上述处理后的废水能否达标排放 ▲(选填:“能”或“不能”)
②加入FeSO4溶液的作用是 ▲ 。w ww.k s5u. co m
14.(8分)以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高。其主要流程如下:
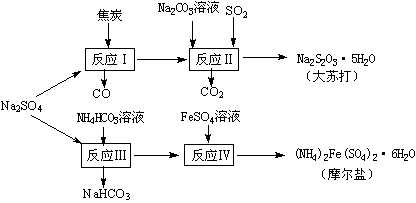
试回答下列问题:w ww.k s5u. co m
(1)已知反应Ⅰ中发生的主要反应为:Na2SO4(s)+4C(s)= Na2S(s)+4CO(g)△H=+569.99 kJ/mol,欲使该反应发生并维持该反应进行的条件是 ▲ 。
(a)常温 (b)常温,并通入少量CO2 (c)高温,并通入适量的O2
(2)配平反应Ⅱ的化学方程式: □Na2S+□Na2CO3+□SO2 =□Na2S2O3+□CO2 ▲
(3)反应Ⅲ温度需控制在35-40℃的较低温度,其主要原因是 ▲ 。
(4)在摩尔盐溶液中加入一种物质的溶液可使NH4+、Fe2+、SO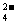 都大量减少,该物质是
都大量减少,该物质是
▲ 。
(5)反应Ⅳ中两种盐溶液混合时,需加入适量的H2SO4,将溶液pH调到1,用离子方程式说明原因: ▲ 。
13.(10分)三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:

(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因 ▲ ,如何用简单方法判断其已洗涤干净 ▲ 。w ww.k s5u. co m
(2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,适宜的加热方式是 ▲ 。

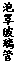
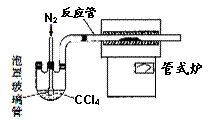 (3)用右图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通人氮气,使CCl4蒸气经氮气载人反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50-60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通人氮气;⑥检查装置气密性。正确的顺序为:⑥→③→ ▲ 。
(3)用右图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通人氮气,使CCl4蒸气经氮气载人反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50-60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通人氮气;⑥检查装置气密性。正确的顺序为:⑥→③→ ▲ 。
(4)已知反应管中发生的主要反应有:Cr2O3 + 3CCl4 → 2CrCl3 + 3COCl2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为 ▲ 。
(5)样品中三氯化铬质量分数的测定
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O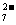 存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
已知:Cr2O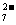 +6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
①该实验可选用的指示剂名称为 ▲ 。w ww.k s5u. co m
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是 ▲ 。
③样品中无水三氯化铬的质量分数为 ▲ 。
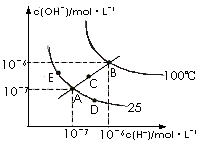
12.水的电离平衡曲线如右图所示,下列说法不正确的是
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显酸性
第Ⅱ卷(非选择题 共78分)
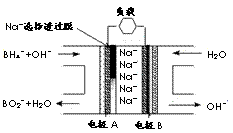
11.直接NaBH4/H2O2燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是
A.电极B材料中包含MnO2层,MnO2可起催化作用
B.电池负极区的电极反应为:w ww.k s5u. co m
BH +8OH――8e-=BO
+8OH――8e-=BO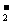 +6H2O
+6H2O
 C.放电过程中,Na+ 从正极区向负极区迁移
C.放电过程中,Na+ 从正极区向负极区迁移
D.在电池反应中,每消耗1L 6 mol/LH2O2溶液,理论
上流过电路中的电子为6NA个
10.下列溶液中微粒的物质的量浓度关系正确的是
A.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)= c(OH-)=c(NH )=c(Cl-)
)=c(Cl-)
B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+2c(H2S)
C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积
混合:c(HCOO-)+ c(H+)<c(Na+)+c(OH-)
 D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积
D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积
混合:3c(CO )+3c(HCO
)+3c(HCO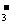 )+3c(H2CO3)=2c(Na+)
)+3c(H2CO3)=2c(Na+)
9.下列离子方程式与所述事实相符且正确的是
A.用H2O2酸性溶液,将海带灰中的I-转变为I2,H2O2+2I-=I2+2OH-
B.溴乙烷与氢氧化钠水溶液共热:C2H5Br + OH- 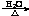 CH2=CH2↑+Br-+H2O
CH2=CH2↑+Br-+H2O
C.高锰酸钾与足量浓盐酸反应制氯气:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O
D.漂白粉溶液中,通入过量的二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
8. 霉酚酸(Mycophenolic acid)是一种生物活性化合物。下列有关霉酚酸的说法正确的是w ww.k s5u. co m
霉酚酸(Mycophenolic acid)是一种生物活性化合物。下列有关霉酚酸的说法正确的是w ww.k s5u. co m
 A.分子式为:C17H20O6
A.分子式为:C17H20O6
B.处于同一平面的碳原子至多9个
C.不能与FeCl3溶液发生显色反应
D.一定条件下, 1 mol霉酚酸最多可与2 mol NaOH反应
7.下列化学实验事实及其解释都正确的是w ww.k s5u. co m
A.滴有酚酞的碳酸氢钠溶液呈浅红色,微热后红色加深,是因为碳酸氢钠分解生成了碳酸钠
B.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
C.用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2反应是放热反应
D.向溴水中滴入植物油,振荡后,油层显无色,说明溴不溶于油脂
6.X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合物RY3、XW4,已知Y、R同主族, Z、R 、W同周期。下列说法不正确的是
A.原子半径:Z>R>W
B.X2W6分子中各原子均满足8电子结构
C.气态氢化物稳定性:HmW>HnR
D.Y、Z、R三种元素组成的化合物水溶液一定显碱性w ww.k s5u. co m
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com