
5.下列关于基因工程的叙述中,正确的是
A.目的基因的核苷酸序列都是已知的
B.接受外源基因的转基因植物成为一个新物种
C.可从人肝脏细胞中提取胰岛素原的mRNA,逆转录获得人胰岛素原基因
D.外源基因转入哺乳动物体细胞核,经细胞核移植等技术可获得转基因动物
4.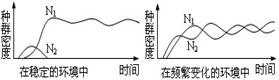 右图反映了种群密度变化与环境因素的关系,
右图反映了种群密度变化与环境因素的关系,
据图分析错误的是
A.若环境条件稳定,持续时间长,则足以使
一种生物被竞争排除或发生生态位变化
B.若环境条件频繁变化,则常常不出现竞
争排除现象
C.海洋和湖泊中浮游植物种类繁多,这是因为这些水体的环境因素较为稳定
D.自然群落中的竞争排除现象是有限的,这是因为自然环境总是不断变化的
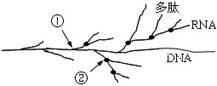
3.右图为原核细胞内某一区域的基因指导蛋白质合成的示意图。据图分析正确的是
A.①②两处都有大分子的生物合成,图中DNA可以
与有关蛋白质结合成染色体
B.①②两处都发生碱基互补配对,配对方式均为A和U、G和C
C.①处有DNA聚合酶参与,②处没有DNA聚合酶参与
D.①处有DNA-RNA杂合双链片段,②处没有DNA-RNA杂合双链片段
2.病毒疫苗和抗血清在现代免疫学预防、治疗中有重要作用。下列分析正确的是
A.消灭人体内病毒只需B淋巴细胞和T淋巴细胞参与
B.一个成熟T淋巴细胞的细胞膜上只有一种抗原的受体
C.人体接种病毒疫苗获得相应免疫力属于被动免疫
 D.以抗血清治疗病毒性重症患者属于二次免疫
D.以抗血清治疗病毒性重症患者属于二次免疫
1.研究发现,成年哺乳动物的脑组织仍可不断产生新的神经元。2007年,科学家发现了将普通皮肤细胞转化为“诱导干细胞”的方法。2009年发现“TRIM32”蛋白质的表达能促进神经干细胞生成神经元。如果这种蛋白质的表达被抑制,则神经干细胞分裂形成的两个子细胞都会保持干细胞状态。下列叙述错误的是
A.“诱导干细胞”与普通皮肤细胞相比,功能有差异,形态、结构也有差异
B.神经干细胞和神经元中的DNA、mRNA和蛋白质都完全相同
C.抑制“TRIM32”的表达有助于建立神经干细胞的细胞系
D.激活成年人沉睡的神经干细胞并促进“TRIM32”的表达,可形成更多新的神经元
20.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.由徐光宪院士发起, 院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、 H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
(1)下列说法正确的是 ▲ 。
 (a)BF3和NH3都是含有极性键的非极性分子
(a)BF3和NH3都是含有极性键的非极性分子
(b)CO2、HCN分子中都含有两个 键和两个π键
键和两个π键
(c)H2S、O3分子都是直线形w ww.k s5u. co m
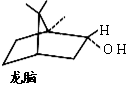
(d)一种双环单萜龙脑(如右图)分子中有4个手性碳原子
(2)NO是人体中的信号分子,有关说法正确的 ▲ 。
 (a)第一电离能N大于O (b)电负性O大于N
(a)第一电离能N大于O (b)电负性O大于N
(c)NO+的结构为:N≡O+
(d)N、O元素在周期表中都处于p区
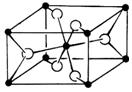
(3)TiO2的天然晶体中,最稳定的一种晶体结构如右图,白球表示: ▲ 原子。
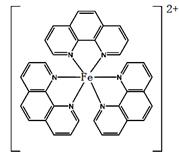 (4)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基形成的一类配合物,其中Fe2+在基态时核外电子排布式为: ▲ ;实验室测定铁的含量可用配位剂邻二氮菲(
(4)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基形成的一类配合物,其中Fe2+在基态时核外电子排布式为: ▲ ;实验室测定铁的含量可用配位剂邻二氮菲( ),它能与Fe2+形成红色配合物(如右图),该配离子中Fe2+配位数为 。
),它能与Fe2+形成红色配合物(如右图),该配离子中Fe2+配位数为 。
(5)乙酸熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出这二聚体的结构: ▲ 。
B.聚合氯化铝(PAC)可以看成是AlCl3水解成为Al(OH)3的中间产物,其化学通式为[Al2(OH)nCl6-n]m(m≤10,n=3-5)。若式中,n接近于6或等于6,则可称为铝溶胶。聚合氯化铝是一种无机高分子混凝剂。某合作学习小组的同学在查阅文献资料后拟用不同的方法制备聚合氯化铝。w ww.k s5u. co m
(1)甲组用凝胶-溶胶法,它们用结晶氢氧化铝、烧碱、CO2及盐酸为试剂生产,其中涉及的氢氧化铝与烧碱反应的化学方程式为: ▲ 。
(2)乙组采用不足量酸溶法,原料主要是铝加工的下脚料铝屑、铝灰和铝渣等,反应原理为:2Al +(6-n)HCl+nH2O = Al2(OH)nCl6-n+3H2↑。该制备方法工艺简单、成本低,利用本身是放热反应,故不需要加热,可能缺点有: ▲ (列举一条)。
(3)丙组拟用高岭土(Al2O3•2SiO2•2H2O)等为原料,经焙烧、盐酸浸取、聚合、熟化、蒸发、干燥等步骤得到固体PAC。其中液体PAC蒸发时,适宜在110℃左右,你认为适宜的加热方法是 ▲ 。
(4)丁组同学对甲、乙、丙组同学制得的样品进行定性实验,请你补充下列实验报告
|
实验序号 |
实验步骤 |
实验现象 |
结论 |
|
① |
用激光笔照射甲组制得的PAC溶液 |
光亮的通路 |
▲ |
|
② |
取乙组制得的样品少许加入铝试剂阿罗明拿 |
变成玫瑰红色 |
▲ |
|
③ |
取丙组样品少许,溶于适量的水制得的淡黄色透明液体中加入氟化铵 |
▲ |
▲ |
(5)戊组同学对丙组固体样品请质检部门用27Al-NMR测试,其中的分散质主要是:Al13O4(OH)24Cl7,属于优质产品。他们另取样品mg少许放在坩埚中充分加热并灼烧,最终得到的固体产物为: ▲ ,若得到固体ng,则制得的样品中铝的质量分数为 ▲ 。



19.(10分)合成氨联产二甲醚是一项具有中国特色的化工工艺,具有节能环保,其主要工艺流程如下:


 已知造气时,主要发生的反应有:CH4+H2O→CO+3H2………①;2CH4+O2→2CO+4H2………②。
已知造气时,主要发生的反应有:CH4+H2O→CO+3H2………①;2CH4+O2→2CO+4H2………②。
CO、CO2均可与H2合成甲醇,合成甲醇后排出的醇后气中有很少量的CO、CO2,需与H2转化为甲烷,防止CO使合成氨催化剂中毒。
(1)NH3(g)→NH3(l) △H ▲ 0 (填:“>”、“<”或“=”,下同) ; △S ▲ 0。
(2)相同体积的天然气,采用“合成氨同时联产二甲醚”和直接合成氨相比,新工艺优越性有 。w ww.k s5u. co m
(a)减少二氧化硫排放 (b)适应低碳经济
(c)可提高氮肥产量 (d)资源综合利用率和经济效益高
(3)在催化剂、高温、高压下,CO2转化为甲烷的化学方程式为 ▲ 。
(4)假定造气时产生的转化气中不含CO2, H2与CO物质的量之比为2.2,空气由80%N2和20%O2组成,天然气中CH4为100%,且①和②的转化率均为100%。则同温同压下通入的空气和水蒸气的体积比,V(空气)/V(水蒸气)= ▲ 。
(5)今有224m3(已折合成标准状况)由CO、H2、N2组成的混合气体,分别合成甲醇和氨,且三种气体均完全转化,驰放气中甲烷忽略不计,若得到液氨34kg,则同时得到二甲醚多少千克? ▲ w ww.k s5u. co m
18.(12分)吲哚昔酚 (idoxifene)可用于治疗骨质疏松症,它的合成路线如下:
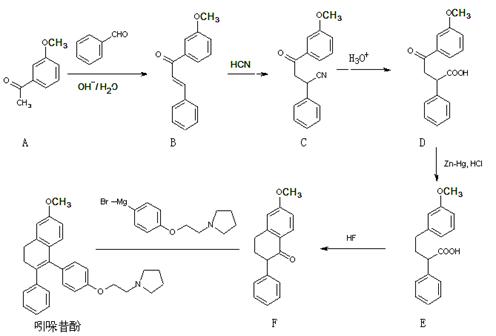
图表 1高 考 资 源 网
(1)反应类型:B→C ▲ ;D→E ▲ 。
(2)D中含氧官能团有: ▲ (写名称)。
(3)满足下列三个条件的A的同分异构体数目有 ▲ 种。
①苯的衍生物,且苯环上只有两个互为对位的取代基;②能发生银镜反应;
③与FeCl3溶液作用不显色
(4)E→F中还有一种副产物G生成,G与F互为同分异构体,且含有三个六员环,G结构简式为: ▲ 。w ww.k s5u. co m
(5)2,2-二甲基戊酸[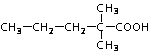 ]是有机合成中间体,请设计合理的方案以丙酮(
]是有机合成中间体,请设计合理的方案以丙酮(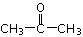 )为唯一有机原料合成2,2-二甲基戊酸(用合成路线流程图表示,并注明反应条件)。
)为唯一有机原料合成2,2-二甲基戊酸(用合成路线流程图表示,并注明反应条件)。
提示:①合成过程中无机试剂任选;②丙酮分子间能发生上图合成路线中A→B的类似反应;③合成路线流程图示例如下:
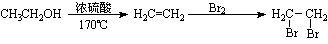
▲
17.(8分)纳米TiO2作为一种光催化剂越来越受到人们的关注,现正广泛开发运用。
(1)制取纳米TiO2的方法很多,氢氧火焰水解法是将TiCl4气体导入氢氧火焰中(700-1000℃)进行水解,其化学反应式为: ▲ 。
 (2)纳米二氧化钛可光解挥发性有机污染物(VOCs),若无水蒸气存在,三氯乙烯降解反应为:C2HCl3+2O2→2CO2+HCl+Cl2,若有足够量的降解后的尾气,实验室检验产物中有氯气的简单方法是: ▲ ;通过质谱仪发现还有多种副反物,其中之一为:
(2)纳米二氧化钛可光解挥发性有机污染物(VOCs),若无水蒸气存在,三氯乙烯降解反应为:C2HCl3+2O2→2CO2+HCl+Cl2,若有足够量的降解后的尾气,实验室检验产物中有氯气的简单方法是: ▲ ;通过质谱仪发现还有多种副反物,其中之一为: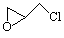 ,则该有机物核磁共振氢谱有 ▲ 个峰。
,则该有机物核磁共振氢谱有 ▲ 个峰。
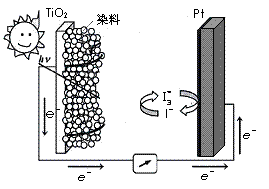
(3)利用半导材料TiO2与染料、铂电极及I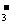 和I-的混合物作电解质(I2+I-
和I-的混合物作电解质(I2+I- I
I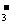 ),可构成染料敏化太阳能电池(DSSCs)工作原理如右图,该电池工作时,正极的电极反应为: ▲ 。
),可构成染料敏化太阳能电池(DSSCs)工作原理如右图,该电池工作时,正极的电极反应为: ▲ 。
(4)在不同的载体(钛片、铝片、陶瓷)表面制备二氧化钛薄膜,来考察不同载体TiO2薄膜光催化使甲基橙脱色,每次光照20min取一次样,实验结果如下。w ww.k s5u. co m
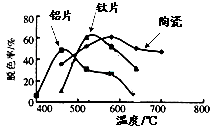 下列说法正确的是 ▲ 。
下列说法正确的是 ▲ 。
(a)不同载体,无论何种温度一定是钛片最好
(b)约在520℃时,钛片载体的光催化活性最好
(c)无论何种载体,催化活性总是随温度的升高而升高
(d)不同负载TiO2薄膜的光催化活性不同
16.(10分)钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料。已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如下图:
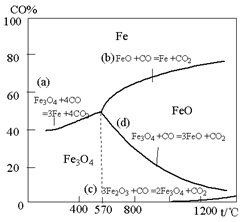 (1)铁在元素周期表中位于 ▲ 周期 ▲
族
(1)铁在元素周期表中位于 ▲ 周期 ▲
族
(2)在温度低于570℃时,还原分两阶段完成,在温度高于570℃时,依次发生的还原反应有:
▲ (选用右图中的a、b、c、d填空)
(3)为减少高炉冶铁时,含CO的尾气排放,下列研究方向不可取的是 ▲ 。
(a)其它条件不变,增加高炉的高度
(b)调节还原时的炉温
(c)增加原料中焦炭与赤铁矿的比例
(d)将生成的铁水及时移出
(4)已知下列反应数值:
|
反应序号 |
化学反应 |
反应热 |
|
① |
Fe2O3(s)+3CO(g)=2Fe(s)+3CO 2(g) |
△H1= -26.7kJ·mol-1 |
|
② |
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) |
△H2= -50.8kJ·mol-1 |
|
③ |
Fe3O4(s)+CO(g)=3FeO(s)+CO2 (g) |
△H3= -36.5kJ·mol-1 |
|
④ |
FeO(s)+CO(g)=Fe(s)+CO2(g)
|
△H4 |
反应④△H4= ▲ kJ·mol-1。
(5)1100℃时, FeO(s)+CO(g)
 Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为: ▲ 。w ww.k
s5u. co m
Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为: ▲ 。w ww.k
s5u. co m
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com