
31.(16分)果蝇是遗传学实验常用的材料,一对果蝇每代可以繁殖出许多后代。回答下列问题:
(1)正常情况下,雄果蝇在减数分裂过程中含有2个Y染色体的细胞名称是 ▲ ,雌果蝇在有丝分裂后期含有_▲_条X染色体。
(2)已知红眼对白眼显性。一只红眼雌果蝇与一只红眼雄果蝇杂交,F1代白眼果蝇都是雄性。甲同学认为,果蝇眼色遗传符合基因的分离定律。乙同学认为,果蝇眼色遗传不符合基因的分离定律。你赞成谁的观点:_▲_(甲、乙)。
(3)已知控制棒眼(E)和圆眼(e)相对性状的基因可能在常染色体上,也可能在X染色体上(Y染色体不含有相应基因)。某同学做了两组“棒眼果蝇×圆眼果蝇”杂交实验,在得到F1以后,这两组杂交实验的亲本及记录每一组亲本各自性别的资料不慎丢失。观察发现F1雌果蝇都是棒眼,试完成以下推断:
①若F1代雄果蝇都是_▲_,则控制棒眼和圆眼相对性状的基因在X染色体上。请画出相应的遗传图解。_▲_(不要求写出配子)
②若F1代雄果蝇既有棒眼又有圆眼,则控制棒眼和圆眼相对性状的基因在_▲_染色体上。
③若F1代雄果蝇都是_▲_,则需继续让F1代雌、雄果蝇相互交配:若F2代中_▲_,则控制棒眼和圆眼相对性状的基因在X染色体上。若F2代中_▲_,则控制棒眼和圆眼相对性状的基因在常染色体上。
2010年温州市高三第一次适应性测试
30.(28分)回答下列Ⅰ、Ⅱ小题
Ⅰ.(16分)将一长势良好的健壮植株在密闭玻璃罩内培养,并置于室外。用CO2测定仪测定玻璃罩内CO2浓度某一天的变化情况,绘成曲线如下图甲所示。下图乙表示该植株处于光照下的叶肉细胞,a表示该细胞的线粒体进行细胞呼吸放出的CO2量,b表示该细胞的叶绿体进行光合作用吸收的CO2量。回答下列问题:(不考虑这一天内植株生长对细胞呼吸和光合作用的影响)
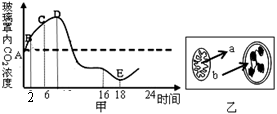 (1)如图甲所示,BC段较AB段CO2浓度增
(1)如图甲所示,BC段较AB段CO2浓度增
加速率减慢的原因是_▲_。从16时到
18时,叶绿体内ATP合成速率的变化是
_▲_。若D点和E点所对应时刻的温度
相同,则D点时的光照强度_▲_(>、
=、<)E点时的光照强度。
(2)如图乙所示,在氧气不足条件下,线粒体内丙酮酸氧化分解的速率将会_▲_。适宜光照条件下,光反应产生的并能够为碳反应所利用的能源物质是_▲_,碳反应产物三碳糖转变成蔗糖的场所是叶绿体_▲_(内、外)。若光照突然停止而其他条件不变,则短时间内叶绿体中三碳酸(C3)的合成速率将会_▲_(变大、不变、变小)。
(3)假设密闭玻璃罩内植株所有进行光合作用的细胞的光合强度一致,图乙表示该植株的一个进行光合作用的细胞,那么,当在图甲中D点时,图乙中a_▲_(>、=、<)b。
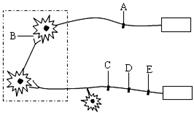 Ⅱ.(12分)下图为一个蟾蜍屈肌反射实验装置的结构模
Ⅱ.(12分)下图为一个蟾蜍屈肌反射实验装置的结构模
式图,回答下列问题:
(1)动作电位沿着神经纤维传导时,神经纤维细胞膜内侧
局部电流的方向与动作电位传导方向_▲_(相同、相
反)。
(2)已知药物X能阻断蟾蜍的屈肌反射活动,肌肉不能
发生收缩,但不知是阻断神经纤维上的兴奋传导,还是阻断神经元之间的兴奋传递,或是两者都能阻断。现有一个如上图所示的屈肌反射实验装置,请利用该实验装置从A、B、C、D、E中选择四个位点作为实验位点进行探究。(在实验位点可以进行药物处理或电刺激。假设药物X在实验位点起作用后,其作用效果在实验过程中都不能消除。)
实验步骤:_▲_
实验结果预测及相应结论:_▲_
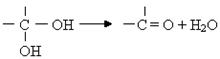
29.(14分)已知:一个碳原子上连有两个羟基时不稳定,易发生下列转化:
某烃A的蒸气密度是相同状况下氢气的53倍,烃A不能使溴的CCl4溶液褪色,但能使酸性KMnO4溶液褪色。氢原子核磁共振谱图表明A有2个吸收峰,强度之比为3∶2,B只有1
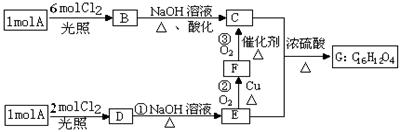 个吸收峰,D有2个吸收峰,
个吸收峰,D有2个吸收峰,
G为环状结构。A可以发生
如右图所示的一系列变化
(生成的其它无机物均未写
出)。请回答下列问题:
(1)A的分子式是_▲_。
(2)指出下列反应的反
应类型:①_▲_、③_▲_。
(3)写出B、G的结构简式:B_▲_、G_▲_。
(4)写出下列反应的化学反应方程式:反应②_▲_;
C和E还能生成高分子化合物,请写出其反应的化学方程式_▲_。
(5)写出满足下列条件的E的所有同分异构体的结构简式(E不必再写):_▲_。
①遇FeCl3溶液显紫色;②能发生消去反应生成碳碳双键。
28.(15分)聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。现用一定质量的铁的氧化物(如下图)为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe 2+。实验步骤如下:
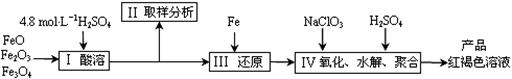
(1)实验室用18.4 mol·L-1的浓硫酸配制250mL4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种带有刻度的移液管)外,还需_▲_。
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是_▲_。
A.控制溶液中Fe2+与Fe3+含量比 B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量 D.确保铁的氧化物酸溶完全
(3)写出步骤Ⅳ中用NaClO3氧化时的离子方程式_▲_(提示:ClO3-转化为Cl-);
已知1mol HNO3的价格为0.16元,1mol NaClO3的价格为0.45元,评价用HNO3代替NaClO3作为氧化剂的利弊,利是_▲_,弊是_▲_。
(4)为了分析产品聚合硫酸铁溶液中SO42-与Fe3+ 物质的量之比,有人设计了以下操作:
(a)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤、洗涤、干燥后,称重,其质量为m g。
(b)另取25mL聚合硫酸铁溶液,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL,用KMnO4酸性溶液滴定,到达终点时用去0.1000 mol/L KMnO4标准溶液VmL。反应的离子方程式为:5Fe2+ + MnO4-+ 8H+ = 5Fe3+ + Mn2+ + 4H2O
回答下列问题:
①判断(a)步骤溶液中SO42-离子已沉淀完全的方法是_▲_;
②在(b)步骤中判断达到终点的现象是_▲_;
③聚合硫酸铁中SO42-与Fe3+的物质的量之比为_▲_(用含m、V的代数式表示)。
27. (15分)甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(15分)甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为
100L),在一定条件下发生反应:CH4(g)+H2O(g)
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关
系如右图。
①已知100℃时达到平衡所需的时间为5min,则用H2表
示的平均反应速率为_▲_。
②图中的P1_▲_P2(填“<”、“>”或“=”),100℃时平衡
常数为_▲_。
③在其它条件不变的情况下降低温度,逆反应速率将_▲_(填“增大”、“减小”或“不变”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)  CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
④该反应的△H_▲_0,△S_▲_0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是_▲_。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了
 三组实验,部分实验条件已经填在下面实验设计表中。
三组实验,部分实验条件已经填在下面实验设计表中。
|
l 实验编号 |
l T(℃) |
l n (CO)/n(H2) |
l P(MPa) |
|
l ⅰ |
l 150 |
l 1/3 |
l 0.1 |
|
l ⅱ |
l _▲_ |
l _▲_ |
l 5 |
|
l ⅲ |
l 350 |
l _▲_ |
l 5 |
A.请在上表空格中填入剩余的实验条件数据。
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
26.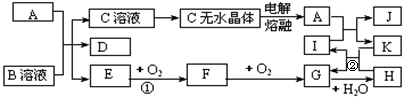 (14分)右图所示各物质是由短周期元素组成的单质及其化合物,图中部分反应条件及生成物未列出。其中A、D、K为单质,其元素在周期表中分处不同周期,且原子最外层电子数:A原子是D原子的两倍,K原子是A原子的两倍;E是能使湿润的红色石蕊试纸变蓝的气体,工业上常用C的无水晶体制备A。有关物质之间的转化关系如右图。请按要求回答:
(14分)右图所示各物质是由短周期元素组成的单质及其化合物,图中部分反应条件及生成物未列出。其中A、D、K为单质,其元素在周期表中分处不同周期,且原子最外层电子数:A原子是D原子的两倍,K原子是A原子的两倍;E是能使湿润的红色石蕊试纸变蓝的气体,工业上常用C的无水晶体制备A。有关物质之间的转化关系如右图。请按要求回答:
(1)写出A的化学式_▲_,I的电子式_▲_。
(2)从C溶液制备C无水晶体的操作要点是_▲_。
(3)写出有关反应的化学方程式:
反应①_▲_;反应②_▲_。
(4)常温下,B溶液的PH_▲_7(填>、<或=),请用离子方程式表示其原因:_▲_。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com