
4.下列关于机体水和无机盐调节的叙述中正确的是
A.血浆渗透压降低时,引起口渴 B.机体失水时,抗利尿激素减少
C.血浆渗透压降低时,抗利尿激素增加
D.机体失水时,血浆渗透压升高
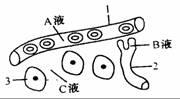
3.右图是人体局部内环境示意图。以下叙述正确的是
A.某人长期营养不良,则会引起C液减少
B.2结构的细胞所处的内环境为淋巴
C.人发生过敏反应,1结构的通透性会升高
D.A液中的O2进入组织细胞被利用至少要通过3层膜结构
2.下列过程发生在人体内环境中的是
A.神经递质与受体结合 B.葡萄糖脱氢分解产生丙酮酸
 C.食物中的蛋白质经消化被分解成氨基酸 D.胰岛细胞合成胰岛素
C.食物中的蛋白质经消化被分解成氨基酸 D.胰岛细胞合成胰岛素
1.关于渗透压的说法不正确的是
A.溶液渗透压是指溶液中溶质微粒对水的吸引力
B.血浆渗透压大小主要与无机盐、蛋白质的含量有关
C.溶液渗透压的大小与溶质微粒数目无关,取决于单位体积溶液中溶质
微粒的体积
D.在37℃时,人的血浆渗透压约为770kPa,相当于细胞内液的渗透压
25.(9分)已知pH = 2的高碘酸(H5IO6)溶液与pH = 12的NaOH溶液等体积混合,所得混合液显酸性;0.01 mol·L-1的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH = 12的NaOH溶液等体积混合,所得混合液显中性。请回答下列问题:
(1)高碘酸是 (填写“强酸”或“弱酸”),理由是___________________
。
(2)已知高碘酸和硫酸锰(MnSO4)在溶液中反应生成高锰酸,碘酸和硫酸,此反应的氧化剂是_________,高锰酸是 产物(填“氧化”或者“还原”), 高碘酸的氧化性比高锰酸要 (填“强”或者“弱”)
(3)在定量分析化学反应中各物质的计量关系时,往往可利用质量守恒、离子电荷守恒和得失电子守恒等规律将问题简单化。现有单质铁溶于稀硝酸反应的化学方程式可表示为:a Fe + b NO3- + c H+ = d Fe2+ + f Fe3+ + g NO↑+ h N2O↑+ k H2O
下列各种情况下的数学等量关系式为:
①b、c、d、f的数学关系式为_____________。
②d、f、g、h的数学关系式为_____________。
③c、g、h的数学关系式为_______________。
24.(11分)某课外兴趣小组测定某品牌牛奶中钙的含量,方法如下:取100mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;然后以0.10mol·L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗12.00mLKMnO4溶液。发生的反应为:5H2C2O4+2KMnO4+3H2SO4 = 5CO2↑+2MnSO4+K2SO4+8H2O
(1)KMnO4溶液应盛在_________(填“酸式”或“碱式”)滴定管中。
(2)若滴定管的规格为25mL,滴定前滴定管中液面的读数为5.20 mL,则滴定管中液体的体积为______(填代号)。
A.5.20 mL B.19.80 mL C.大于19.80 mL D.小于19.80 mL
(3)本实验是否需要外加指示剂? (填“是”或者“否”)。到达滴定终点时,溶液的颜色由 色变为 色。
(4)滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(5)该牛奶中钙的含量为_________mg/100mL。
(6)下列操作会使实验结果偏低的是____________(填代号)。
A.滴定管未用KMnO4溶液润洗就直接盛装KMnO4溶液
B.向锥形瓶转移沉淀时,损失部分沉淀
C.开始时平视读数,滴定完成时俯视读数
D.CaC2O4的表面没有洗涤干净,吸附少量C2O42-等杂质
23.(10分)A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体;两种是固体。请回答以下问题:
(1)写出由A、B两元素形成的原子个数比为1∶1的化合物为__________,此化合物能使酸性KMnO4溶液退色,体现该化合物具有 性。
(2)D的最高价氧化物对应水化物是一种重要的工业产品。下列关于此化合物描述不准确的是( )
A.其浓溶液具有强氧化性,能与大多数金属单质反应
B.其稀溶液具有吸水性,能净化多种气体
C.该物质具有脱水性,在乙烯的实验室制备中有直接体现
D.该物质可用铁或者铝容器运输
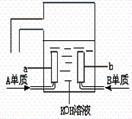 (3)用A元素的单质与B元素的单质可制成新型的化学电源,已在宇宙飞船中使用。其构造如图所示。两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
(3)用A元素的单质与B元素的单质可制成新型的化学电源,已在宇宙飞船中使用。其构造如图所示。两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
则a是 极,电极反应式为____________________,
b是 极,电极反应式为____________________。
22.(12分)工业制硝酸的主要反应是:
4NH3(g)+5O2(g)  4NO(g)+6H2O (g);△H = -1025 kJ·mol-1
4NO(g)+6H2O (g);△H = -1025 kJ·mol-1
(1)该反应的平衡常数表达式为K=________________;升高温度K值__________ (填“增大”、“减小”或“不变”)。
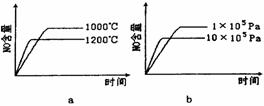
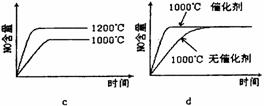
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填序号)。
(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
|
时间/浓度 |
c(NH3)(mol/L) |
C(O2)(mol/L) |
C(NO)(mol/L) |
|
起始 |
0.8 |
1.6 |
0 |
|
第2min |
0.6 |
a |
0.2 |
|
第4min |
0.3 |
0.975 |
0.5 |
|
第6min |
0.3 |
0.975 |
0.5 |
|
第8min |
0.8 |
1.6 |
0.5 |
①起始时物料比c (O2):c (NH3)>1.25,其原因是____________________________。
②反应在第2min到第4min时O2的平均反应速率为______________ mol/L·min;
③反应在第2min改变了反应条件,改变的条件可能是 ________ (填序号)
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是___________________________________。
21.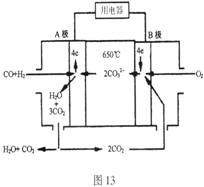 (8分)熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为
(8分)熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为
650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。
请回答下列问题:
(1)B极为_________极,发生_________(填“氧化”或“还原”)反应
(2)电池总反应为
___________________________________________。
(3)以此电源电解足量的CuSO4溶液,阳极产生气体0.56 L(已换算为标况),则阴极产物的质量为 g。电解后溶液体积为1 L,溶液的PH约为 。
(4)电池中的电解质碳酸钠形成的水溶液体系不能用带玻璃塞的试剂瓶保存,其原因是
(用化学方程式表示)
20.在一定体积pH =12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH =11。若反应后溶液的体积等于Ba(OH)2溶液和NaHSO4溶液体积之和,则Ba(OH)2溶液和NaHSO4溶液体积之比是
A.1:9 B.1:1 C.1:2 D.1:4
第Ⅱ卷 (非选择题 共50分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com