
17.答案 A
16.答案 C
15.答案B
[解析]S与O2生成SO2,再与H2O生成H2SO3,可以与NaOH生成Na2SO3,B项正确。A项,SiO2不与水反应,错;C项中CuO,D项中Fe3O4均不与H2O反应,故错。
14.答案C
[解析]MgSO4中SO42 -内部为共价键,故A项错;硬水和软水中均含有Ca2+、Mg2+,只是硬水中含量较多,B项错。C项,雾属于胶体,故可以发生丁达尔效应,C项正确;玻璃属于混合物,D项错。
13.答案 A
[解析]①②反应中消耗O2的量相等,两个反应也仅有O2作为氧化剂,故转移电子数是相等的,A项正确。①中H2O的H、O两元素的化合价没有变,故不作氧化剂,B项错;铜和钢构成原电池,腐蚀速度加快,C项错;钢铁是铁和碳的混合物,在潮湿的空气的中易发生吸氧腐蚀,属于电化学腐蚀,故D项错。
12.答案B
[解析 ]生铁、普通钢和不锈钢中的碳含量依次降低,故B项错。
11.答案D
[解析] A项,明矾净水的原理是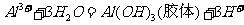 ,利用
,利用 的吸附性进行净水;B项,是因为轮船主要用铁造外壳,铁在海水中易被腐蚀.镀上比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率;氧化镁的熔点是2852℃,可用于制作耐高温材料;电解
的吸附性进行净水;B项,是因为轮船主要用铁造外壳,铁在海水中易被腐蚀.镀上比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率;氧化镁的熔点是2852℃,可用于制作耐高温材料;电解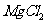 饱和溶液,发生地化学反应
饱和溶液,发生地化学反应
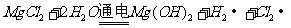 ,不会产生金属镁,电解熔融的
,不会产生金属镁,电解熔融的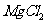 能制取单质镁,发生的反应
能制取单质镁,发生的反应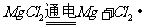 。
。
10.答案BC
[解析]锡青铜属于合金根据合金的特性,熔点比任何一种纯金属的低判断A错;由于锡比铜活泼,故在发生电化学腐蚀时,锡失电子保护铜,B正确;潮湿的环境将会加快金属的腐蚀速率,C正确;电化学腐蚀过程实质是有电子的转移,属于化学反应过程,D错。
9. 答案 (1)MnO2+2FeSO4+2H2SO4 MnSO4+Fe2(SO4)3+2H2O
答案 (1)MnO2+2FeSO4+2H2SO4 MnSO4+Fe2(SO4)3+2H2O
(2)Fe(OH)3、Al(OH)3
(3)Cu2+、Zn2+

 (4)MnO2+H2O+e- MnOOH+OH-(或2MnO2+H2O+2e- Mn2O3+2OH-)
(4)MnO2+H2O+e- MnOOH+OH-(或2MnO2+H2O+2e- Mn2O3+2OH-)
(5)锌、二氧化锰
[解析](1)根据FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,可以写其反应方程式
 2FeSO4+MnO2+2H2SO4 MnSO4+Fe2(SO4)3+2H2O。
2FeSO4+MnO2+2H2SO4 MnSO4+Fe2(SO4)3+2H2O。
(2)根据反应后滤液(Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+)加氨水调pH至5.4,结合题表可知滤渣A的主要成分为Fe(OH)3和Al(OH)3。
(3)根据题表可知加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+。
(4)碱性锌锰干电池中Zn作负极,则MnO2作正极得电子。其电极反应式应为
 MnO2+H2O+e- MnOOH+OH-
MnO2+H2O+e- MnOOH+OH-
 或2MnO2+H2O+2e- Mn2O3+2OH-。
或2MnO2+H2O+2e- Mn2O3+2OH-。
(5)从碱性锌锰干电池的原料可知,其废旧电池可回收利用的物质为锌和MnO2。
8.答案 (1)炉身 炉腰
 (2)2P+5FeO+3CaO
Ca3(PO4)2+5Fe 脱氧和调整钢的成分
(2)2P+5FeO+3CaO
Ca3(PO4)2+5Fe 脱氧和调整钢的成分
(3)后 避免Cr被氧化(或“氧吹前加入Cr会形成炉渣被除去”)
(4)CO 燃料(或还原剂)
[解析](1)高炉炼铁,铁矿石的主要反应是在炉身部分发生,在炉腰处生成生铁和炉渣。
 (2)除钢中的磷的化学方程式为2P+5FeO+3CaO
Ca3(PO4)2+5Fe,加入硅、锰和铝的目的是脱去氧和调整钢中的成分。
(2)除钢中的磷的化学方程式为2P+5FeO+3CaO
Ca3(PO4)2+5Fe,加入硅、锰和铝的目的是脱去氧和调整钢中的成分。
(3)为了防止Cr元素被高温下的氧氧化,应在氧吹后加入。
(4)炼铁时用到C作燃料生成CO作还原剂,炼钢时钢中本身含有C,因此都有CO产生,而CO是有毒气体,对环境有污染,同时CO可以燃烧生成CO2。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com