
19.(6分)
氯酸钾是一种强氧化剂,多用来制造火柴、炸药、鞭炮和烟花等。制取氯酸钾可用以下方法:
无隔膜电解热的氯化钾水溶液,电解的生成物相互反应制得氯酸钾。
(1)电解池中的电极反应式是:
阴极 ,
阳极 。
(2)写出生成氯酸钾的离子方程式 。
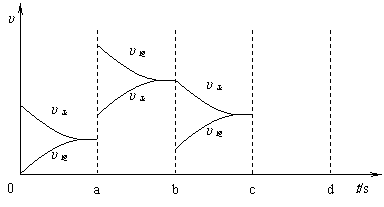
18.(6分)
下图表示在密闭容器中反应:2SO2(g)+O2(g) 2SO3(g) △H<0达到平衡时,由于反应条件改变而引起反应速率和化学平衡变化的情况。则a→b过程中改变的条件可能是 ;b→c过程中改变的条件可能是
。若在c时刻开始增大压强,在d时刻达到平衡,请将反应速率的变化情况画在c→d处。
2SO3(g) △H<0达到平衡时,由于反应条件改变而引起反应速率和化学平衡变化的情况。则a→b过程中改变的条件可能是 ;b→c过程中改变的条件可能是
。若在c时刻开始增大压强,在d时刻达到平衡,请将反应速率的变化情况画在c→d处。

17.(6分)在含有相同浓度Cl-和I-离子的溶液中,逐滴加入AgNO3溶液时,
离子首先沉淀析出,当第二种离子开始沉淀时Cl-和I-离子的浓度之比为 。(保留到小数点后两位)
已知:Ksp(AgI)=1.5×10-16,Ksp(AgCl)=1.56×10-10Blog/Index.asp?UserId=997609
16. 可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是 ( )
 A.以NaCl溶液或NaOH溶液为电解液时,正极反应不同
A.以NaCl溶液或NaOH溶液为电解液时,正极反应不同
 B.以NaCl溶液为电解液时,负极反应为:Al+4OH--3e-=[Al(OH)4]-
B.以NaCl溶液为电解液时,负极反应为:Al+4OH--3e-=[Al(OH)4]-
 C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH减小
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH减小
 D.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
第II卷(非选择题 共60分)
15. 将浓度均为2mol/L的AgNO3与Cu(NO3)2溶液各0.5L混合,以铜为电极进行电解,一段时间后阴极上有1.6g铜析出,则下列说法正确的是 ( )
A.电路上通过电子的物质的量是0.05mol
B.电解后溶液中[Cu2+]=1.5mol/L
C.阴极反应式为Cu2++2e-=Cu
D.阳极产生氧气的体积为280ml
14. 将等物质的量的K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于指定容器中,加入足量的水,搅拌、静置、过滤。取滤液,用铂电极电解一段时间。则两极区析出的氧化产物与还原产物的质量比约为 ( )
A. 35.5:108 B. 108:35.5 C. 8:1 D. 1:2
13.铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,工作时的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,下列结论正确的是 ( )
A.Pb为正极被氧化 B.溶液的pH不断减小
C.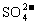 只向PbO2处移动 D.溶液pH不断增大
只向PbO2处移动 D.溶液pH不断增大
12.下列说法正确的是 ( )
A.ΔH<0的反应可能自发进行 B.熵减小的反应一定可自发进行
C.熵增大的反应一定可自发进行 D.ΔH>0的反应不可能自发进行
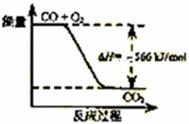
11.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
 Na2O2(s)+CO2(g)=Na2CO3(s)+
Na2O2(s)+CO2(g)=Na2CO3(s)+
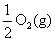 ΔH=-226 kJ/mol
ΔH=-226 kJ/mol
 根据以上热化学方程式判断,下列说法正确的是 (
)
根据以上热化学方程式判断,下列说法正确的是 (
)
 A.CO的燃烧热为283 kJ
A.CO的燃烧热为283 kJ
 B.右图可表示由1molCO生成CO2的反应过程和能量关系
B.右图可表示由1molCO生成CO2的反应过程和能量关系
 C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
 D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
10. 氢氧化镁固体在水中溶解,有下列平衡:
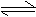
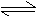
|
哪种物质可使Mg(OH)2固体的质量减少 ( )
A.Na2CO3 B.MgC12 C.NaC1 D.NH4C1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com