
2.文中有这样一句话:“他是个不习惯言谢的人,但他以他的方式表达深藏于心的感谢和敬意。”说说看,金龙是以怎样的方式来表达深藏于心的感谢和敬意的?
1.“我”对金龙同学的态度开始时是怎样的?后来发生了怎样的变化?
29.(16分)肉桂醛在食品、医药化工等方面都有应用。
(1)质谱分析肉桂醛分子的相对分子质量为132。其分子中碳元素的质量分数为81.8%,
其余为氢和氧。分子中的碳原子数等于氢、氧原子数之和。肉桂醛的分子式是 。
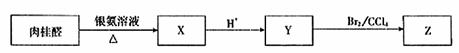 (2)肉桂醛具有下列性质:
(2)肉桂醛具有下列性质:
请回答:
①肉桂醛是苯的一取代物,核磁共振氢谱显示,苯环侧链上有三种不同化学环境的氢原
子,其结构简式是 。(本题均不考虑顺反异构与手性异构)
②Z不能发生的反应类型是 。
A.取代反应 B.消去反应 C.加成反应 D.加聚反应
③Y与乙醇在一定条件下作用得到肉桂酸乙酯,该反应的化学方程式是 。
④Y的同分异构体中,属于酯类且苯环上只有一个取代基的同分异构体有 种。
其中任意一种的结构简式是 。
(3)已知I.醛与醛能发生反应,原理如下:
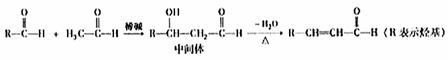
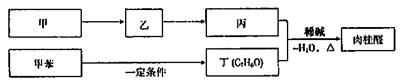 II.合成肉桂酸醛的工业流程如下图所示,其中甲烷。
II.合成肉桂酸醛的工业流程如下图所示,其中甲烷。
请回答:
①丙和丁生成肉桂的化学方程式是 。
②醛和酯也可以发生如“I”的反应。食用香料肉桂酸乙酯通过如下反应合成:
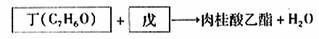
戊的名称是 。
28.(14分)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业
上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
 N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
 2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸
气所放出的热量为 。
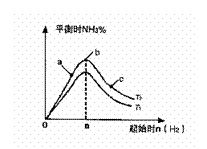
(2)某科研小组研究:在其他条件不变的情况下,改变起始
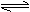 物氢气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。实验
物氢气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。实验
结果如图所示:(图中T表示温度,n表示物质的量)
①图像中T2和T1的关系是:T2 T1(填“高于”“低
于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 (填字母)。
③在起始体系中加入N2的物质的量为 mol时,反应后氨的百分含量最大。
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。现以H2、O2、熔融盐
Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。
写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。
27.(14分)某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
⑴提出假设 ①该反应的气体产物是CO2。 ②该反应的气体产物是CO。
③该反应的气体产物是 。
⑵设计方案 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,
测定参加反应的碳元素与氧元素的质量比。
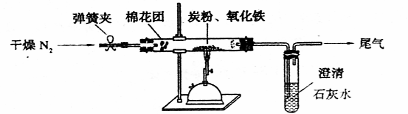
⑶查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)
饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式: 。
⑷实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,
放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质
量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为 。
⑸数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式: 。
⑹实验优化 学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 。
②从环境保护的角度,请你再提出一个优化方案: 。
26.(16分)A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、
W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数
与主族序数相等。
(1)E元素在周期表中的位置为 。
(2)由A、B、W三种元素组成的18电子微粒的电子式为 。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方
程式 。常用硫酸处理BaO2来制备A2W2,写出该反应的化
学方程式 。
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸
溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出
反应的离子方程式 。
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800
℃,DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生
成气体的体积是 (标准状况下)。
(6)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的
物质的量之比为1:2,且无气体生成,则该反应的离子方程式为 。
13.CuI是一种不溶于水的白色固体,它可由反应:2Cu2++4I-=2CuI↓+I2而得到。现用铜 片、石墨作电极,电解KI溶液制取CuI。为确认反应情况,通电前在溶液中又加入了少量的酚酞试液和淀粉溶液。电解一段时间后得到白色沉淀,同时阴极区溶液变红,阳极区溶液变蓝。下列说法正确的是 ( )
①铜片做阴极,石墨做阳极 ②铜片做阳极,石墨做阴极
③阳极有氧气生成 ④阴极有氢气生成
⑤白色沉淀在阳极附近生成 ⑥白色沉淀在阴极附近生成
⑦阳极区溶液变蓝的原因是2Cu+4I――4e-=2CuI↓+I2 碘遇淀粉变蓝
⑧阳极区溶液变蓝的原因是4OH――4e―=2H2O+O2↑O2将I-氧化为I2,碘遇淀粉变蓝
A.只有②④⑤⑦ B.只有①④⑥⑦ C.只有②③⑤⑧ D.只有①③⑥⑧
12.某化学小组欲探究①溴乙烷在不同溶剂中与NaOH发生不同类型的反应;②某CuO和Cu混合粉末中CuO的质量分数。下列实验设计方案及预期结论合理的是 ( )
|
|
探究 |
方案 |
结论 |
|
A |
① |
取2mL溴乙烷,加入适量NaOH水溶液,加热。一段时间后,向溶液中滴加AgNO3溶液,有淡黄色沉淀产生 |
溴乙烷中的溴变成了Br-,溴乙烷与NaOH水溶液发生取代反应 |
|
B |
① |
取2mL溴乙烷,加入适量NaOH乙醇溶液,加热,将产生的气体通入KMnO4酸性溶液中,溶液褪色 |
反应生成乙烯,溴乙烷与NaOH乙醇溶液发生消去反应 |
|
C |
② |
称取质量为m1的混合物,在空气中加强热至质量不再变化,冷却、称量,所得固体质量为m2 |
CuO的质量分数为: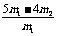 |
|
D |
② |
称取质量为m1的混合物,放入足量稀硝酸中溶解,过滤、洗涤、干燥、称量,残留固体质量为m2 |
CuO的质量分数为: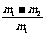 |
11.室温下,下列关于pH均为9、体积均为10mL的NaOH溶液和CH3COONa溶液比较的说法,正确的是 ( )
A.两种溶液中的c(Na+)相等 B.分别加热到相同温度时,CH3COONa溶液的pH小
C.分别加水稀释到100mL时,两种溶液的pH依然相等
D.两溶液中由水电离出的c(OH-)之比为10-9/10-5
9.已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O +O2 +4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是 ( )
+O2 +4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是 ( )
A.O2和S2O 是氧化剂,Fe2+是还原剂 B.每生成1mol Fe3O4,则转移电子数为2mol
是氧化剂,Fe2+是还原剂 B.每生成1mol Fe3O4,则转移电子数为2mol
C.参加反应的氧化剂与还原剂的物质的最之比为1:1
D.若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol
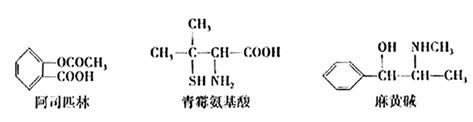 10.下列对三种有机物的叙述不正确的是(-SH的性质类似于-OH) ( )
10.下列对三种有机物的叙述不正确的是(-SH的性质类似于-OH) ( )
A.三种有机物都能发生酯化反应
 B.青霉氨基酸不能与盐酸反应,但能与NaOH反应
B.青霉氨基酸不能与盐酸反应,但能与NaOH反应
C.麻黄碱的分子式为C10H15ON,苯环的一氯代物有3种
D.阿司匹林能与适量NaOH反应生成可溶性阿司匹林( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com