
11、常见物质的鉴别或检验
氧气:带火星的木条伸入集气瓶,看是否复燃
二氧化碳: 注入少量澄清石灰水,振荡,看石灰水是否变浑浊
氢氧化铜 Cu(OH)2 蓝色沉淀 氢氧化铁 Fe(OH)3 红褐色沉淀
BaSO4 AgCl 不溶于酸的白色沉淀。
10. 燃烧条件的探究:
|
步骤 |
现象 |
结论 |
|
烧杯内倒入开水,将铜片置于烧杯上 |
铜片上的白磷开始燃烧,而红磷没有燃烧 |
可燃物温度必须达到着火点以上 |
|
向烧杯内的热水中通入氧气 |
烧杯内的白磷开始燃烧 |
可燃物要与氧气接触 |
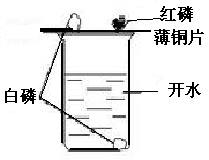 燃烧的条件:(三者缺一不可)
燃烧的条件:(三者缺一不可)
(1)可燃物 (2)氧气(或空气)
(3)可燃物温度达到着火点以上
9. 溶液的酸碱度检验 - PH试纸 (PH范围在0-14之间)
测定PH值最简单的方法是使用PH试纸,测定时,用玻璃棒把待测溶液滴在PH试纸上(绝不能将试纸伸入待测试液中,更不能将试纸投入到待测溶液中去),然后把试纸显示的颜色跟标准比色卡对照,便可知溶液的PH值。
酸液:加碱(或水)可使PH值升高;碱液:加酸(或水)可使PH值降低。
8.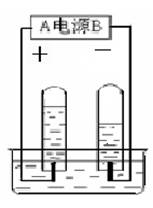 电解水实验(正氧负氢,氢二氧一)
电解水实验(正氧负氢,氢二氧一)
A、装置 ―― 水电解器
B、电源种类 - 直流电
C、加入硫酸或氢氧化钠的目的-------增强水的导电性
D、化学反应: 2H2O 通电 2H2↑ + O2↑
产生位置 负极 正极
体积比 2 : 1
质量比 1 : 8
F、检验:O2 - 用带火星的木条检验 -- 木条复燃
H2 - 用一根燃着的木条检验 -- 气体燃烧,产生淡蓝色的火焰
G、结论: ①水是由氢、氧元素组成的。②化学变化中,分子可分而原子不可分。
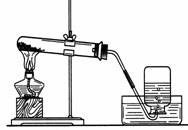
7. 实验室制H2的方法是:
实验室制H2的方法是:
反应原理:Zn+2HCl==ZnCl2+H2↑
反应装置:固液不加热型
收集方法:排水法或向下排空气法(氢气比空气轻且难溶于水)
氢气纯度的检验:用拇指堵住集满气体的试管口,靠近酒精灯
火焰,移开拇指点火,当听到有尖锐爆鸣声时说明气体
不纯;当听到声音很小时说明气体已纯,可以安全点燃。
2. 不能用浓盐酸(浓盐酸有挥发性,产生的气体中含有HCl);不能用稀硫酸,(因为生成的CaSO4微溶于水,覆盖在大理石的表面阻止了反应的进行)。
6.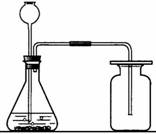 实验室制CO2的方法是:
实验室制CO2的方法是:
反应原理:CaCO3+2HCl==CaCl2+H2O+CO2↑
收集方法:向上排空气法(因为CO2 可溶于水,故不能使用排水法收集)
CO2的验满:用燃着的木条放在瓶口,如果木条熄灭说
明收集满了。
CO2的验证:通入澄清石灰水,如果石灰水变浑浊,说明是二氧化碳气体。
5、氧气的实验室制法
①、发生装置:
固固加热型、固液不加热型
②、收集方法:向上排空气法(氧气密度比空气大);
排水法收集 (氧气不易溶于水)
由于向上排空气法收集的氧气不纯,因此一般使用排水法收集
实验原理:
实验步骤:a. 检验装置的气密性;
b. 装入反应物质。注意:反应物为粉末状,应该用药匙或者纸槽;
c. 固定装置
d. 首先预热,然后对准有药品的地方集中加热;
e.当导管有连续、均匀的气泡冒出时,开始收集气体;
f. 将导管移出水面
g. 熄灭酒精灯;
(如果步骤f和g顺序相反,会使水倒流至试管中,可能使试管破裂。)
查-装-定-点-收-离-熄
①如果反应物品为高锰酸钾时,试管口还需要塞上少量棉花,避免高锰酸钾粉末堵塞导管或进入水槽中;
②试管口应略微向下倾斜(防止冷凝水回流,使试管底部破裂),导管应略微深入试管;
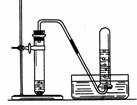 ③如果用向上排空气法收集,导管口应该尽量伸入集气瓶底部。收集完毕,集气瓶正放于实验台上(氧气密度比空气大)。
③如果用向上排空气法收集,导管口应该尽量伸入集气瓶底部。收集完毕,集气瓶正放于实验台上(氧气密度比空气大)。
④ 验满:将带火星的木条置于集气瓶口验满。
验证:将带火星的木条伸入集气瓶中验证。
工业上制制O2的方法是:分离液态空气(物理变化)
双氧水(过氧化氢溶液)制取氧气:
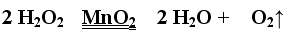
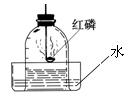
4、测量空气中氧气含量
a、可燃物要求:足量且燃烧后生成物不能为气体。
b、装置要求:气密性良好
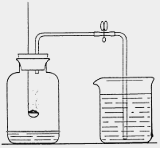 c、现象:有大量白烟产生,待集气瓶冷却后,打开止水夹,烧杯中的水进入集气瓶,约占集气瓶容积的1/5
c、现象:有大量白烟产生,待集气瓶冷却后,打开止水夹,烧杯中的水进入集气瓶,约占集气瓶容积的1/5
d、结论:O2约占空气总体积的1/5;
e、氮气的性质:既不能燃烧也不支持燃烧,难溶于水
f、探究: ①液面上升小于1/5原因:装置漏气,红磷量不足,未冷却完全就打开止水夹。
②能否用铁、铝代替红磷?不能 原因:铁、铝不能在空气中燃烧
 能否用碳、硫代替红磷?不能 原因:产物是气体,不能产生压强差,水无法进入集气瓶。
能否用碳、硫代替红磷?不能 原因:产物是气体,不能产生压强差,水无法进入集气瓶。
3、吸入空气与呼出气体的比较
方法:用排水法收集呼出的气体。
|
实验步骤 |
呼出气体中 |
空气中 |
结论 |
|
滴入数滴石灰水 |
变浑浊 |
无变化 |
呼出气体CO2含量大于空气中 |
|
插入燃着的木条 |
木条熄灭 |
燃烧正常 |
呼出气体O2含量小于空气中 |
|
对着干燥的玻璃片呼气 |
有水雾出现 |
无变化 |
呼出气体H2O含量大于空气中 |
 注意:吸入空气与呼出气体成分是相同的。
注意:吸入空气与呼出气体成分是相同的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com