
22、(8分)根据下面框图填空。已知:物质A的焰色反应呈黄色;物质G是一种白色物质,微溶于水;D、E为两种气体单质;M是一种合成树脂,常用于制备塑料和合成纤维。
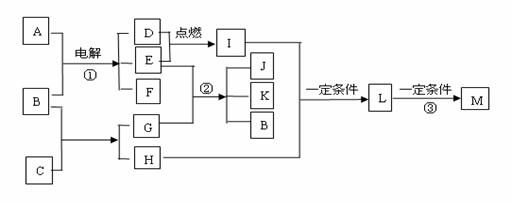
回答:(1)物质C的电子式__________________________
(2)写出反应的化学方程式。
反应①_____________________________________________________
反应②_____________________________________________________
反应③_____________________________________________________
21、(14分)今有原子序数依次增大的A、B、C、D、E、F六种元素。已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间,两两皆能反应且均能生成盐和水。D和E各有如下表的电子层结构。在一般情况下,B元素不能与A、C、D、E元素的游离态化合而生成B的化合态。
|
元素 |
最外层电子数 |
次外层电子数 |
|
D |
X |
X+4 |
|
E |
X+1 |
X+4 |
按要求填空:
(1)各元素的元素符号分别为A_____________,B______________,C______________,D_____________,E_____________,F______________。
(2)用电子式表示B与F形成化合物的过程____________________________________。
(3)D的氢化物的化学式_________________,E的氢化物的化学式_________________,两者的稳定性__________________ 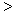 ___________________。
___________________。
(4)A与C两元素的最高价氧化物对应的水化物反应的离子方程式为________________。
(5)把A的单质投入到重水中,反应的氧化产物的化学式为_____________________,还原剂为__________________,反应的离子方程式为_______________________________。
20、(6分)高温下,向1mol炽热的Cu2S中通入足量的水蒸气,生成2molH2,同时还生成金属铜和一种有刺激性气味的气体。
(1)写出该反应的化学反应方程式____________________________________________。
(2)该反应中被氧化的元素是____________,被还原的元素是_____________。
(3)每生成1molH2,氧化剂与还原剂之间所转移电子的物质的量是_________mol。
19、 (1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个分别装有0.3g NaHCO3、0.3g Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3、Na2CO3同时倒入试管中,观察到现象如下:
①试管中(填产生沉淀或气体及反应速率等相关现象)___________________________
_____________________________________________________________________________。
②两试管中气球大小(包含试管)体积之比约为(填最简单整数比)(酸均足量)_____。
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义):
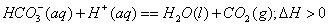
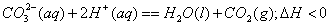
甲下结论的方法是否正确__________。(填“正确”或“不正确”)
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
|
序号 |
试剂1 |
试剂2 |
混合前温度 |
混合后最高或最低温度 |
|
① |
50mL水 |
2.5g NaHCO3固体 |
20℃ |
18.5℃ |
|
② |
50mL水 |
3.2g Na2CO3固体 |
20℃ |
23.0℃ |
|
③ |
35mL稀盐酸 |
含2.5g NaHCO3的饱和溶液15mL |
20℃ |
18.8℃ |
|
④ |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶液15mL |
20℃ |
20.6℃ |
|
⑤ |
50mL稀盐酸 |
2.5g NaHCO3固体 |
20℃ |
17.4℃ |
|
⑥ |
50mL稀盐酸 |
3.2g Na2CO3固体 |
20℃ |
23.5℃ |
请你帮助填写相关内容:
①该研究报告的题目是《______________》;
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为________和________;通过上述实验可得出多条结论,如:
a:NaHCO3的溶解是_________(吸热或放热)的过程;
b:Na2CO3的饱和溶液和盐酸的反应是_________(吸热或放热)反应;
c:NaHCO3固体与稀盐酸反应的反应热约是___________的热效应之和。
18、在下列有机物中,既能发生加成反应,又能发生酯化反应的是[B]
①CH3CH2CH2OH ②CH2OH(CHOH)4CHO ③CH2=CH-CH2OH
④CH2=CH-COOC2H5 ⑤CH3CH=CHCOOH
A、①③⑤ B、②③⑤ C、①②④ D、②③④
第Ⅱ卷(非选择题,共64分)
17、标准状况下,向3mol·L-1的NaOH溶液100mL中缓慢通入4.48LCO2气体,充分反应后溶液中离子浓度大小排列顺序正确的是[D]
A、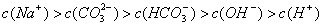
B、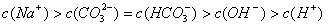
C、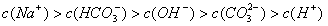
D、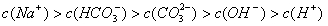
16、某烯烃A,分子式为C8H16,A在一定条件下被氧化只生成一种物质B,B能使石蕊试液变红。已知:
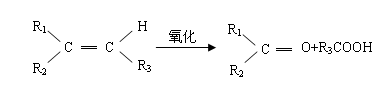
则符合上述条件的烃A有( A )种(不考虑顺反异构)。
A、2 B、3 C、4 D、5
15、下列实验能达到预期目的的是[C]
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸;
②用NaOH溶液除去苯中的少量苯酚;
③用饱和NaHCO3溶液除去CO2中的少量SO2;
④用加热的方法提取NH4CI固体中混有少量碘;
⑤用醋和澄清石灰水验证蛋壳中含有碳酸盐;
⑥用米汤检验食用加碘盐中含碘;
⑦用碘酒验证汽油中含有不饱和烃;
A、①②⑥⑦ B、①③⑤⑥⑦ C、②③⑤⑦ D、②③④⑤⑦
14、右图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是[C]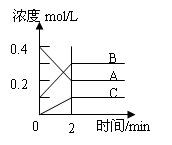
A、A是反应物
B、前2 minA的分解速率为0.1mol(L·min)
C、达平衡后,若升高温度,平衡向正反应方向移动
D、达平衡后,若增大压强,平衡向逆反应方向移动
13、20℃时,将某盐R的溶液蒸发掉10g水后,恢复到20℃,需再加入8g盐R(无结晶水),溶液即达饱和。若先加入2g盐R后再将盐溶液蒸发掉30g水,恢复到20℃,溶液也达饱和。则20℃时,盐R的溶解度是[C]
A、20g B、25g C、30g D、60g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com