
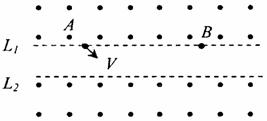
20.如图所示,L1和L2为两条平行的虚线,
L1上方和L2下方都是垂直纸面向外的
磁感应强度相同的匀强磁场,A、B两
点都在L1上。带电粒子从A点以初速
V斜向下与L1成45°角射出,经过偏
转后正好过B点,经过B点时速度方
向也斜向下,且方向与A点方向相同。
不计重力影响,下列说法中正确的是( )
A.该粒子一定带正电
B.该粒子一定带负电
C.若将带电粒子在A点时初速度变大(方向不变),它仍能经过B点
D.若将带电粒子在A点时初速度变小(方向不变),它不能经过B点
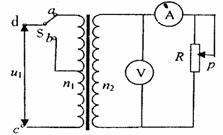
17.如图所示,理想变压器原、副线圈的匝数比
为5:1,b是原线圈的中心抽头。电压表和
电流表均为理想电表,从某时刻开始在原线
圈c、d两端加上交变电压,其瞬时值表达
式为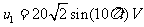 ,则 ( )
,则 ( )
A.当单刀双掷开关S与a连接时,电压表的示数为4V
B.当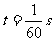 ,c、d问的电压瞬时值为10V
,c、d问的电压瞬时值为10V
C.单刀双掷开关S与口连接,在滑动变阻器触头P向
下移动的过程中,电压表和电流表的示数均变大
D.保持触头P位置不变,当单刀双掷开关S由a扳向b时,电压表和电流表的示数均变大
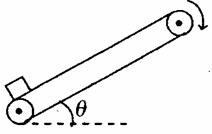 18.如图所示,足够长的传送带以恒定速率沿顺时针方向运转。现将一个物体轻轻放在传送
带底端,物体第一阶段被加速到与传送带具有相同的速度,第二阶段匀速运动到传送带顶端.则下列说法中正确的是 ( )
18.如图所示,足够长的传送带以恒定速率沿顺时针方向运转。现将一个物体轻轻放在传送
带底端,物体第一阶段被加速到与传送带具有相同的速度,第二阶段匀速运动到传送带顶端.则下列说法中正确的是 ( )
A.第一阶段和第二阶段摩擦力对物体都做正功
B.第一阶段摩擦力对物体做的功等于第一阶段
物体动能的增加量
C.第二阶段摩擦力对物体做的功等于第二阶段
物体机械能的增加量
D.两个阶段摩擦力对物体所做的功等于物体机
械能的减少量
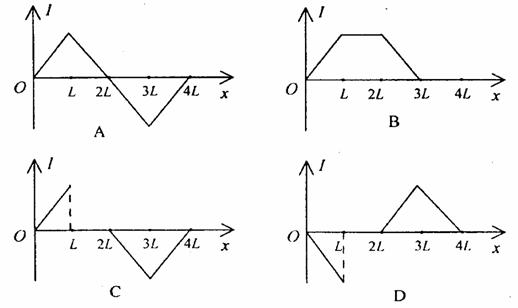
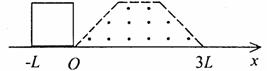 19.如图所示,等腰梯形内分布着垂直纸面
19.如图所示,等腰梯形内分布着垂直纸面
向外的匀强磁场,它的底边在x轴上且
长为3L,高为L,底角为45°。有一边
长也为L的正方形导线框沿x轴正方向
做匀速直线运动穿过磁场区域,在t=0时
刻恰好位于如图所示的位置。若以顺时针方向为导线框中电流正方向,在下面四幅图中能正确表示导线框中电流和位移关系的是 ( )
16.如图所示,点电荷+4Q与+Q分别固定在A、B两点,C、D两点将AB连线三等分。现使一个带负电的检验电荷,从C点开始以某一初速度向右运动,不计检验电荷的重力.则关于该电荷在CD之间的运动,下列说法中可能正确的是 ( )
 A.一直做减速运动,且加速度逐渐变小
A.一直做减速运动,且加速度逐渐变小
B.做先减速后加速的运动
 C.一直做加速运动,且加速度逐渐变小
C.一直做加速运动,且加速度逐渐变小
D.做先加速后减速的运动
15.已知万有引力常量为G,则在下列给出的各种情景中,能求出月球密度的是 ( )
A.在月球表面上让一个小球做自由落体运动,测出下落的高度H和时问t
B.测出月球绕地球做匀速圆周运行的周期T和轨道半径r
C.发射一颗绕月球做匀速圆周运动的卫星,测出卫星的轨道半径r,和卫星的周期T,
D.发射一颗贴近月球表面绕月球做匀速圆周运动的探月飞船.测出飞船运行的周期丁
14.如图所示,两个等大、反向的水平力F分别作厢在物体A和B上,A、B两物体均处于 静止状态。若各接触面与水平地面平行,则A、B两物体各受几个力? ( )
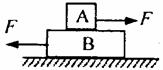 A.3个、4个 B.4个、4个
A.3个、4个 B.4个、4个
C.4个、5个 D.4个、6个
13.已知碳酸、亚硫酸、次氯酸的平衡常数如下表:
|
H2CO3 |
H2SO3 |
HClO |
|
K1=4.30×10-7 |
K1=1.54×10-2 |
K=2.95×10-8 |
|
K2=5.61×10-11 |
K2=1.02×10-7 |
|
下列反应的离子方程式书写正确的是 ( )
A.NaClO溶液中通少量CO2:2ClO-+CO2+H2O=2HClO+CO2-3
B.Na2CO3溶液中通少量SO2:2CO2-3+SO2+H2O=2HCO-3+SO2-3
C.NaHCO3溶液中通少量SO2:2HCO-3+SO2=CO2+SO2-3+H2O
D.NaClO溶液中通少量SO2:2ClO-+SO2+H2O=2HClO+SO2-3
11.下列实验过程中产生的现象与对应的图形正确的是 ( )
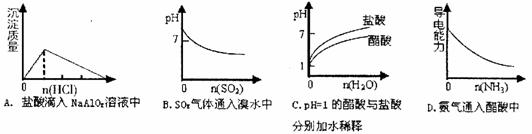
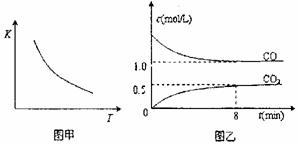 12.一定条件下某密闭容器中发生反应:FeO(s)+CO(g)
12.一定条件下某密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g),已知该反应的平衡常数(K)的与温度(T)的关系如图甲,图乙是T1温度下该反应的c-t关系图像。则下列说法正确的是 ( )
Fe(s)+CO2(g),已知该反应的平衡常数(K)的与温度(T)的关系如图甲,图乙是T1温度下该反应的c-t关系图像。则下列说法正确的是 ( )
A.保持其他条件不变,增大压
强(压缩体积),化学反应
速率不变
B.保持其他条件不变,降低温
度,c(CO2)/c(CO)减小
C.保持温度和体积不变,混合
气体的密度不变不能作为此
化学平衡状态的标志
D.保持温度T1不变,8分钟后继续加人足量氧化铁粉末并充人0.75mol/L的CO气体,平衡时CO的转化率为33.3%
10.A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列推断正确的是 ( )
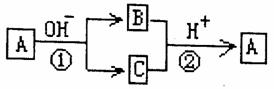 A.X元素为铝
A.X元素为铝
B.反应①和②互为可逆反应
C.X元素可能是金属,也可能是非金属
D.反应①和②一定为氧化还原反应
9.设NA为阿伏加德罗常数,下列叙述正确的是 ( )
①lmolCH3CH2C(CH3)3所含甲基个数为4NA
②2.8g乙烯和2.8g聚乙烯中含碳原子数均为0.2NA
③1.0L1.0mol·L-1CH3COOH溶液中,CH3COOH分子数为NA
④6g乙酸乙酯中 含共用电子对数为1.4NA
含共用电子对数为1.4NA
⑤标准状况下,22.4L乙醇完全燃烧后生成CO2的分子数为2NA
⑥常温常压下,17g甲基(一14CH3)所含的中子数为9NA
⑦标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA
⑧lmolC15H32分子中含碳一碳共价键数目为14NA
A.①③⑤⑦ B.②③⑥⑧ c.①②④⑧ D.①②⑥⑧
8.海水是一个巨大的化学资源库,下列有关海水综合利用的说法错误的是 ( )
A.历史最悠久的海水淡化方法是蒸馏法
B.海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,HDO与H2O化学性质不同
C.从海水中可以得到NaCl电解熔融NaCl可制备金属钠
D.从海水中提取镁可以采用下列方法:
海水 Mg(OH)2
Mg(OH)2 MgCl2溶液→MgCl2→MgCl2(熔解)
MgCl2溶液→MgCl2→MgCl2(熔解) Mg
Mg
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com