
33.(17分)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
Ⅰ.四种制取Cu2O的方法
(1)火法还原。用炭粉在高温条件下还原CuO;
|
(3)电解法。反应为2Cu + H2O === Cu2O + H2↑。则阳极产物是 ;
(4)最新实验研究用肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
Ⅱ.用制得的Cu2O进行催化分解水的实验
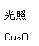 (1)一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气,发生反应:
(1)一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气,发生反应:
|
时间/min |
20 |
40 |
60 |
80 |
|
n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
2H2O(g) 2H2(g)+O2(g);△H = +484kJ·mol-1,不同时段产生O2的量见下表:
2H2(g)+O2(g);△H = +484kJ·mol-1,不同时段产生O2的量见下表:
计算:
前20min的反应速率 v(H2O)= ;该反应的平衡常数表达式K = ;达平衡时,至少需要吸收的光能为 kJ。
 (2)用以上四种方法制得的Cu2O在某相同条件下分别对水催化分解,产生氢气的速率v随时间t变化如图所示。下列叙述正确的是 。
(2)用以上四种方法制得的Cu2O在某相同条件下分别对水催化分解,产生氢气的速率v随时间t变化如图所示。下列叙述正确的是 。
A.c、d方法制得的Cu2O催化效率相对较高
B.d方法制得的Cu2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有关
D.Cu2O催化水分解时,需要适宜的温度
32. (13分)化合物B是有机合成中间体,制取C4H4O4和E的转化关系如下图所示。已知C能使溴水退色。
(13分)化合物B是有机合成中间体,制取C4H4O4和E的转化关系如下图所示。已知C能使溴水退色。
回答下列问题:
(1)指出反应类型:① ;③ 。
(2)E的结构简式为: 。
(3)写出②、④转化的化学方程式:② ;④ 。
31.(16分)广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+、SO42-和CO(NH2)2等。制备流程如下图:
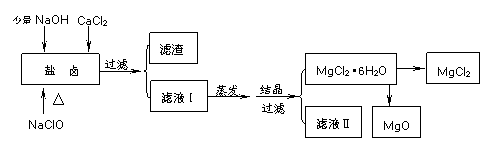
(1)滤渣的成分是 (写化学式);滤液Ⅱ中所含主要的杂质离子是 (写离子符号)。
 (2)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为
;加入NaClO的另一个作用是 。
(2)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为
;加入NaClO的另一个作用是 。
(3)温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式 ;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是 ;若要得到无水MgCl2须采取的措施是 。
30.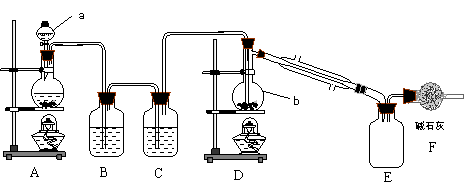 (18分)已知SnCl4极易水解,熔点-33℃,沸点114.1℃;锡的熔点232℃,沸点2260℃。下图是实验室制备SnCl4的装置示意图:
(18分)已知SnCl4极易水解,熔点-33℃,沸点114.1℃;锡的熔点232℃,沸点2260℃。下图是实验室制备SnCl4的装置示意图:


请回答下列问题:
(1)仪器b的名称: ;说出仪器a在中学实验中的两种用途: 、 。
(2)写出装置A中反应的离子方程式: 。
(3)装置B、C中的药品分别为: 、 ;装置F的作用是: 。
(4)实验制得的SnCl4中因溶解了Cl2而略显黄色。提纯SnCl4的方法是 。
23.一定条件下的密闭容器中:4NH3(g)+5O2(g) 4NO(g)+6H2O(g);
4NO(g)+6H2O(g);
△H= - 905.9kJ·mol-1,下列叙述正确的是
A.4molNH3和5molO2反应,达到平衡时放出热量为905.9KJ
 B.平衡时v正(O2)= v逆(NO)
B.平衡时v正(O2)= v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量减小
D.平衡后升高温度,混合气体中NO含量降低
二卷题
22.下列离子方程式中,错误的是
A.氯化铁溶液中加入铜粉:Fe3++Cu == Fe2++Cu2+
B.将含等物质的量的NaHCO3和Ba(OH)2溶液混合:
HCO3-+Ba2++OH-== BaCO3↓+H2O
C.少量SO2通入次氯酸钙溶液中:Ca2++2ClO- +SO2+H2O == CaSO3↓+2HClO
D.少量AlCl3溶液滴入过量的NaOH溶液中:Al3++4OH-== [Al(OH)4]-
12.下列关系的表述中,正确的是
A.0.1mol·L-1NaHSO4溶液中:c(Na+)+ c(H+)= c(SO42-)+c(OH-)
B.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1∶1
C.pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)不相等
D.0.1mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
11.设阿伏加德罗常数的数值为nA,下列说法正确的是
A.1molNa2O2和水完全反应,转移电子数为2nA
B.0.5L0.2mol·L-1FeCl3溶液中,含Fe3+ 离子数为0.1nA
C.理论上氢氧燃料电池负极消耗11.2L标准状况下气体,外线路通过电子数为nA
D.常温常压下,28g乙烯和丙烯混合气体含有的碳原子总数为2.5nA
10.下列实验中,能达到预期目的的是
A.用过滤法除去Fe(OH)3胶体中的FeCl3
B.用25mL碱式滴定管量取20.00mLNa2CO3溶液
C.向某溶液中滴入BaCl2溶液和稀HNO3,来检验溶液中是否含有SO42-
D.将Na投入到CuSO4溶液中置换出铜,来证明钠的金属性比铜强
9.短周期元素A、B、C的原子序数依次递增,三者原子最外层电子数之和为14,A原子的次外层电子数等于B原子的最外层电子数,A与C同主族。则下列叙述正确的是
A.原子半径:A<B<C
B.氢化物稳定性:A<C
C.B与A的化合物比B与C的化合物熔点低
D.A与C的化合物属于大气污染物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com