
6.答案:A
[解析]由题意可知:C2H4(g)+3O2(g) 2CO2(g)+2H2O(l);△H=-1411.0kJ·mol-1,
2CO2(g)+2H2O(l);△H=-1411.0kJ·mol-1,
C2H5OH(1)+3O2(g) 2CO2(g)+3H2O(l);△H=-1366.8kJ·mol-1,将上述两个方程式相减得:C2H4(g)+H2O(l)
2CO2(g)+3H2O(l);△H=-1366.8kJ·mol-1,将上述两个方程式相减得:C2H4(g)+H2O(l) C2H5OH(l);△H=-44.2kJ·mol-1。
C2H5OH(l);△H=-44.2kJ·mol-1。
5.答案:A
[考点]本题考查了热化学方程式书写规律。
[解析]由已知⑴、 ⑵热化学方程式可知:⑴-⑵ 即可得出答案。
4.答案:B
[解析]以煤等燃料作为主要生活燃料时会产生大量的空气污染物;私人汽车代替公交车会使汽油的消耗量增加,带咯啊的空气污染物增多,限制使用电动车会增加有害气体的排放。因此正确的选项为B
3.答案:B
[解析]需要加热的化学反应也可能是放热反应,如可燃物的燃烧反应,A选项错误;原电池是将化学能转化为电能的装置,故C选项错误;水力发电是将机械能转化为电能的过程,故D选项错误。正确选项为B
2.答案:B
[解析]中和反应为放热反应,B对,中和反应有水生成,但有水生成的不一定是放热反应,如H2+CuO
 H2O+Cu是吸热反应,D错,从表中分析当加入HCl溶液5mL、NaOH溶液45mL反应后温度为22℃,故实验时环境温度小于22℃,A错,加入HCl溶液30mL反应放热最多,应是酸碱正好中和,故C(NaOH)=1.0mol/L·30mL /20mL=1.5 mol/L,C错。
H2O+Cu是吸热反应,D错,从表中分析当加入HCl溶液5mL、NaOH溶液45mL反应后温度为22℃,故实验时环境温度小于22℃,A错,加入HCl溶液30mL反应放热最多,应是酸碱正好中和,故C(NaOH)=1.0mol/L·30mL /20mL=1.5 mol/L,C错。
1.答案:D
[解析]A选项中同位素是指中子数不同、质子数相同的不同核素(原子)的互称,选项中给出的是分子,错误;B中PH=1的溶液为强酸性环境,解答时应在离子组Na+、NO3-、HCO3-、Fe2+ 中增加H+,分析可知碳酸氢根离子和氢离子不共存,在氢离子存在时硝酸根离子和亚铁离子不能共存,错误;C中明矾的净水原理是其溶于水电离产生的铝离子水解生成氢氧化铝能吸附水中悬浮物,而漂白粉是由其成分中的次氯酸钙和水、二氧化碳反应生成的次氯酸能杀菌消毒,作用原理不同,错误;D中此反应的△H>0,说明此反应是吸热反应,也就是金刚石的具有能量大于石墨,物质具有的能量越大,该物质越不稳定,正确。
22.(09年山东理综·28)(14分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂 反应的△H(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂 反应的△H(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e
-  H1=1175.7
kJ·mol-1
H1=1175.7
kJ·mol-1
PtF6(g)+e-=PtF6-(g)
 H2=-771.1
kJ·mol-1
H2=-771.1
kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g)
 H3=482.2
kJ·mol-1
H3=482.2
kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的
 H=_____________
kJ·mol-1。
H=_____________
kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4*)=c(Cl-)。则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
高考真题答案与解析
化 学
[考点5] 化学能与热能
21.(09年江苏化学·17)(8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
A.热裂解形成燃油
B.露天焚烧
C.作为有机复合建筑材料的原料
D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+O2(g)=H2O(l) △H=-285.84kJ·mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0mol·L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解 速率(×10-3 mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
20.(09年广东化学·23)(11分)
磷单质及其化合物的、有广泛应用。
(1)同磷灰石[主要成分]在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)
; H
H
①上述反应中,副产物矿渣可用来 。
②已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Cas3(PO4)2(s)+2CaSi o3(s)+SiF4(g) ;△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g);△H2
SiO2(s)+CaO(s)=CaSiO3(s) ;△H3
用△H1、△H2和△H3表示 H,
H, H=
。
H=
。
(2)三聚磷酸可视为三个磷酸分子
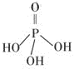 (磷酸结构式见右图)之间脱去两
(磷酸结构式见右图)之间脱去两
个水分子产物,其结构式为
。三聚磷酸钠
(俗称“五钠”)是常用的
水处理剂,其化学式为 。
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为 。
②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a) Ni2+ + H2PO2-+ →
Ni++ H2PO3-+
(b)6H2PO-2
+2H+ =2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a)。
③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点: ;原理上的不同点: ;化学镀的优点: 。
19.(09年福建理综·23) 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为 。
(2)元素的非金属性为(原子的得电子能力):Q W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是 。
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量akJ和bkJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的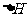 =
(注:题中所设单质均为最稳定单质)。
=
(注:题中所设单质均为最稳定单质)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com