
12. 答案:B
[解析]因没释放电子,质子数、中子数都不变,所以有:
根据质量数守恒:6×2 = 4k+d+2
根据质子守恒: 6 = 2k+d
解得:k = 2,d = 2。
11. 答案:A
[解析] 质子数相同、中子数不同的同一元素的不同原子互称为同位素,A正确。 质量数为144,
质量数为144, 质量数为150,B不正确。核素是具有一定数目质子数和中子数的原子,C不正确。D项中核外电子数均为62,前者中子数为82,后者中子数为88。
质量数为150,B不正确。核素是具有一定数目质子数和中子数的原子,C不正确。D项中核外电子数均为62,前者中子数为82,后者中子数为88。
10.答案:A
[解析]HBr是共价化合物,其电子式不能写成离子型。
9.答案:D
[解析]Na2O2 中氧为-1价;乙醇分子式C2H6O,CH3CH2OH为结构简式;16S的结构示意图为

8.答案:C
[解析]活泼金属与活泼非金属形成离子键。
7.答案:C
[解析]同位素是指质子数相同而中子数不同的同意元素的不同核素。A项中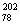 Pt和
Pt和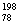 Pt为同一元素的不同核素;B项中
Pt为同一元素的不同核素;B项中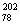 Pt的中子数为124,
Pt的中子数为124,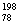 Pt的中子数为120;D项中
Pt的中子数为120;D项中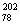 Pt和
Pt和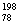 Pt虽质量数不同,但质子数相同,应互称为同位素。
Pt虽质量数不同,但质子数相同,应互称为同位素。
6.答案:C
[解析]A项,C的非金属性比Si强,CH4比SiH4稳定;B项,O2-与F-核外电子排布相同,F原子序数大,F-半径小;D项,P的非金属性比As强,H3PO4酸性比H3AsO4强。
5.答案:B
[解析]根据题意,符合条件的化合物有NaNO3和MgCO3两种。B项中MgCO3微溶于水,MgO为离子化合物。
4.答案: C
[解析]本题是一个表格信息题,解决这类问题的关键在于:反复对比数据,结合所学知识,做出判断并进行验证。因讨论的元素为短周期元素,L、Q均+2价,L原子半径大于Q原子半径,所以L为Mg,Q为Be;M显+3价,原子半径较略小,所以M为Al;R、T均有-2价,R还有+6价,且R原子半径大于T原子半径,所以R为S元素,T为氧元素。H2O>H2S(沸点),由于水分子间存在氢键;L、Q单质与盐酸反应速率L>Q(即Mg>Be);M、T形成的是Al2O3,具有两性;L2+(Mg2+)与R2-(S2-)的核外电子数不相等。
3.答案: D
[解析]S原子最外层电子数为6。32S、33S核电荷数相同,电子数相同,质子数相同,中子数不同。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com