
26.答案: (1)为了防止亚铁化合物被氧化。
(2)CO2 H2O NH3。
(3)Fe+H2PO4- +Li+-2e- LiFePO4↓+2H+。
LiFePO4↓+2H+。
(4) +3NaOH
+3NaOH
 +HOCH2CH2OH+Na2CO3
+HOCH2CH2OH+Na2CO3
+CH3OH
(5)FePO4+Li++e-  LiFePO4
LiFePO4
[思路](1)由亚铁的还原性可以想到选择惰性气氛的原因;(2)因为其他物质为气体,结合质量守恒进行配平可知有CO2、H2O、NH3生成。(3)由于阳极材料是Fe,又因该极生成LiFePO4可以该极的大体转化过程为“Fe LiFePO4”,根据质量守恒可知还有H2PO4- 和Li+参加反应,从而完成电极反应的书写。(5)充电时,被充电池的正极与电源的正极相连,此时被充电池实为电解池,被充电池的正极即为电池解的阳极。
LiFePO4”,根据质量守恒可知还有H2PO4- 和Li+参加反应,从而完成电极反应的书写。(5)充电时,被充电池的正极与电源的正极相连,此时被充电池实为电解池,被充电池的正极即为电池解的阳极。
[解析](1)根据题给信息,磷酸亚铁锂中存在的是Fe2+离子,很容易被空气中的O2氧化,故灼烧时需用惰性气体保护。
(3)方法二中,阳极的电极反应包括Fe原子失去电子生成Fe2+,还有Fe2+与H2PO4- 、Li+的沉淀反应。
(4)M分子中含3个酯键,跟足量NaOH反应时,这3个酯键都会断裂。
(5)可充电电池充电时,发生的反应是电池放电时的逆过程,据此原理,原电池放电时,正极是+3价铁得电子成为+2价铁。
25.答案: (1)Zn; 正极。
(2)锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀; b。
(3)2H++2e- = H2; 87 g。
[解析](1)还原性较强的Zn作负极,失电子有负极经外电路流向正极。
(2)除杂原则是:加入物要过量(以除尽杂质)、不能引入新杂质,故选Zn将Cu2+置换而除去。
(3)阴极上,阳离子得电子,Mn2+和H+比较,应是H+得电子。
由关系式知:MnSO4-MnO2-2e-,通过2 mol电子产生1 mol MnO2,即87 g。
24.答案: (1)①正极; ②4OH--4e- = 2H2O+O2↑。
③水减少的质量:100 g×(1-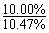 ) = 4.5 g
) = 4.5 g
生成O2体积: ×
× ×22.4 L·mol-1 = 2.8 L
×22.4 L·mol-1 = 2.8 L
④16 g
⑤甲:碱性增大,因为电解后,水量减少,溶液中NaOH浓度增大
乙:酸性增大,因为阳极上OH-生成O2,溶液中H+离子浓度增加
丙:酸碱性大小没有变化,因为K2SO4是强酸强碱盐,浓度增加不影响溶液的酸碱性
(2)能继续进行,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应。
[解析](1)c电极质量增加是此题的突破口:说明c处有Cu析出,即c为阴极。由此可推出b为阳极(OH-失电子)、a为阴极、M为负极、N为正极。
丙中K2SO4浓度的变化,是此题计算的关键。电解K2SO4溶液相当于电解水,据溶质守恒有:100×10% = [100-m(水)]×10.47%,得m(水) = 4.5 g,即电解水0.25 mol。
据电子守恒有如下关系:
2H2O(丙) - 4e- - O2(b极) - 2Cu(c极)
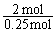 =
= 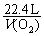 =
= 
解得:V(O2) = 2.8 L m(Cu) = 16 g
23.答案: (1)负极材料为Li(还原剂),Li – e- = Li+。
(2)2SOCl2+4e- = 4Cl-+S+SO2。
(3)出现白雾,有刺激性气体生成; SOCl2+H2O = SO2↑+2HCl↑。
(4)因为构成电池的两个主要成份Li能和氧气水反应,且SOCl2也与水反应。
[解析](1)分析反应的化合价变化,可得Li为还原剂(作负极),失电子:Li-e- = Li+。
(2)SOCl2为氧化剂,得电子,从题给电池反应可推出产物:Cl-+S+SO2。(或用总反应减去负极反应)
(3)题中已给出信息:碱液吸收时的产物是Na2SO3和NaCl,则没有碱液吸收时的产物应为SO2和HCl,进而推出现象。
22.答案:D
[解析]此类题,在确定二极后,先考虑放电的各种情况,再考虑充电的各种情况。放电时,Li作负极,失电子(A项正确),生成的Li+从负极移向正极(D项错)。充电时,是电池反应的反方向,从总方程式可知,此时的Li0.85NiO2既发生氧化反应又发生还原反应,B项正确。C项,由于Li可以与水反应,故应为非水材料,正确。
21.答案:A
[解析]判断二极是解题的关键。从电解总反应知:金属Cu被氧化,铜电极应为阳极,发生氧化反应,电极反应式为:2Cu-2e-+2OH- Cu2O+H2O,所以B项、C项均错;同时可知当有0.1 mol电子转移时,应有0.05 mol
Cu2O生成,D项也错。石墨电极应与电源的负极相连,发生还原反应:2H++2e-
Cu2O+H2O,所以B项、C项均错;同时可知当有0.1 mol电子转移时,应有0.05 mol
Cu2O生成,D项也错。石墨电极应与电源的负极相连,发生还原反应:2H++2e- H2↑,A项正确。
H2↑,A项正确。
20.答案:D
[解析]由总反应方程式知,I-失去电子(氧化反应),Fe3+得电子(被还原),故A项、B项正确。当电流计为零时,即说明没有电子发生转移,可证明反应达平衡,C项正确。加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,甲中石墨作负极,D项错。
[考点分析]此题考查了氧化还原反应与原电池的关系、化学平衡在原电池中的应用。(难度提升,创新题)
19.答案:B
[解析]微生物主要成分是蛋白质,高温条件下蛋白质变性,失去活性,A不正确。通入燃料C6H12O6的极为负极,负极反应为:C6H12O6+6H2O-24e- = 6CO2↑+24H+(能放出CO2应该是酸性,所以右边写H+。不能在左边加OH-、右边写H2O),B项正确。正极反应为:6O2+24H++24 e- = 12H2O,从两极反应可知:负极生成H+,正极消耗H+,即通过质子交换膜从负极到正极传导H+,选项C不正确。从总反应C6H12O6+6O2 = 6CO2+6H2O可知,每消耗1 mol氧气,理论上能生成标准状况下CO2气体22.4 L,D项错。
18.答案:D
[解析]从放电顺序K+、Ca2+、Na+、Mg2+、Al3+、H+(水)可知,电解氯化镁溶液时,阳离子只能是水电离出的H+得电子,得不到单质Mg。制金属镁是电解熔融的氯化镁。
17.答案:A
[解析]正极O2得电子,溶液显碱性或中性时,正极反应都为:O2+2H2O+4e-=4OH-,A正确。铝作负极,铝失电子,中性溶液(NaCl)中的负极反应为:Al-3e- = Al3+,碱性溶液(NaOH)中的负极反应为:Al+4OH--3e- =AlO2- +2H2O,B不正确。在碱性时总的电池反应式为:4Al+3O2+4OH- = 4AlO2- +2H2O,溶液pH降低,C项错。电池工作时,电子从负极流向正极,D项错。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com