
20.(15分)下图是200 mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量(m)随温度(t)变化的关系曲线。(已知草酸锰不稳定,但其中锰元素的化合价在300 oC以下不变)

试回答下列问题:
(1)写出B点固体产物的化学式 ;
(2)从B点到c点过程中固体物质质量不变的原因是 。
(3)通过计算确定D点处产物的相对分子质量,并推断其合理的化学式。
(4) 从D点到E点过程中固体物质质量增加的原因是 。
19.(8分)已知40℃时四种化合物在水中和液氨中的溶解度如下:
  溶质
溶质溶解度 溶剂 |
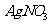 |
 |
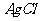 |
 |
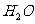 (液) (液) |
170g |
9.2g |
1.5×10-4g |
33.3g |
 (液) (液) |
86g |
97.2g |
0.8g |
0g |
上述四种物质在液氨溶液中发生复分解反应的化学方程为 ,
在水中发生复分解反应的离子方程式为 。
18.(12分) 某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
①装好实验装置。②检查装置气密性。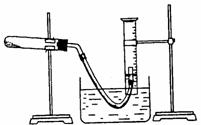 ③把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag。
③把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图,导管出口高于液面)。
⑥测量收集到气体的体积。
⑦准确称量试管和残留物的质量为bg。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
回答下列问题:
⑴ 如何检查装置的气密性? 。
⑵以下是测量收集到气体体积必须包括的几个步骤;①调整量简内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是: (请填写步骤代号)。
⑶测量收集到气体体积时,如何使量筒内外液面的高度相同?
。
(4)如果实验中得到的氧气体积是c L(已换算成标准状况下),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):M(O2)= 。
17.(9分)实验室需要用0.1mol/LNaOH溶液450mL,根据溶液配制和使用回答下列问题:
(1)实验中除了托盘天平、烧杯、容量瓶外还需要的其它仪器有:
。
(2)根据计算得知,所需称量的NaOH的质量为 g。
(3)下列操作对所配浓度有何影响(填写字母)偏大的有 。
A.称量用了生锈的砝码;
B.将NaOH放在纸张上称量;
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时俯视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
16.要配制浓度约2mol·L-1NaOH溶液100mL,下面操作正确的是
A.称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C.称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D.用100mL量筒量取40mL 5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
班别 座号 姓名 评分
选择题答题表
15.有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)/mol·L-1为
A .(y-2x)/a B .(y-x)/a C .(2y-2x)/a D .(2y-4x)/a
14.由CO、H2和O2组成的混和气体60 mL,在一定条件下恰好完全反应,测得生成物在101kPa 120℃下对氢气的相对密度为18.75,则原混和气体中H2所占的体积分数为
A. 1/6 B. 2/3 C. 1/4 D. 1/3
13.已知甲、乙溶质的质量分数与溶液密度的关系如下表所示:
|
溶质的质量分数 |
甲溶液密度╱g·cm-3 |
乙溶液密度╱g·cm-3 |
|
1% |
0.95 |
1.02 |
|
5% |
0.92 |
1.04 |
|
9% |
0.90 |
1.07 |
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合,下列叙述中,正确的是
A.混合后,甲、乙溶液中溶质的质量分数均大于5%
B.混合后,乙溶液中溶质的质量分数大于5%,甲溶液中溶质的质量分数小于5%
C.混合后,甲溶液中溶质的质量分数大于5%,乙溶液中溶质的质量分数小于5%
D.混合后,甲、乙溶液中溶质的质量分数均等于5%
12.某气体的摩尔质量为Mg·mol-1,N表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X.则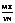 表示的是
表示的是
A.以g为单位VL该气体的质量 B.以g为单位1L该气体的质量
C.1L该气体中所含的分子数 D.以L为单位1mol该气体的体积
11.设NA为阿伏加德罗常数,下列叙述中正确的是
A.1 mol NaHSO4晶体中离子总数为2NA
B.标准状况下,11.2L NO与11.2L O2 混合后所含原子数为2NA
C.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
D.5.6 g铁粉与硝酸反应失去的电子数一定为0.3 NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com