
4、在常温时,可以把二氧化碳、甲烷、氧气归为一类物质,下列物质中与它们属于同一类的是
A、大理石 B、二氧化硫 C、食盐 D、生铁
3、在我们身边的物质中,不属于氧化物的是
A.刚玉(Al2O3) B. 水 C. 酒精 D.生石灰(CaO)
2、生活中处处有化学。下列物质的用途与其化学性质无关的是:
A.干冰用于人工降雨 B.二氧化碳用于灭火
C.液氧用做火箭的助燃剂 D.一氧化碳用于冶炼金属
注意:每道选择题有四个选项,其中只有一项符合题意。请将答案填入答题卷的答案栏中,选错、不选、多选或书写不清的,均不给分。
1、生活中我们经常看到下列现象,其中发生了物理变化的是
A.蜡烛熔化 B.煤气燃烧
C.铁锅生锈 D.蔬菜腐烂
21.(本题包括1个小题,共12分)
 如图装置闭合电键时,电流计的指针将发生偏转。试回答下列问题。
如图装置闭合电键时,电流计的指针将发生偏转。试回答下列问题。
(1)写出A池H2电极的名称____
________________,该电极反应式
_______________________。
(2)B池工作一段时间后,要使B池
CuSO4溶液恢复到工作前的浓度可加
入适量的物质是_______________
a.Cu b.CuSO4
c.CuO d.CuCO3
(3)如果将B池中的两电极都换成铜电极,则工作一段时间后溶液的颜色_____________。(填“加深”、“变浅”或“无变化”)
(4)如果电极材料不变,将B中CuSO4溶液换成NaCl溶液,工作一段时间后,C电极附近pH___________(填“增大”、“减小”或“无变化”),B池工作时总的反应离子方程式为:_______________________________________________.
(5)电极材料不变,若B中为lL Cu(NO3) 2和KNO3的混合溶液,通电一段时间,两极均产生11.2L(标准状况)气体,则析出铜的质量为_____________________________.

20.(本题包括2个小题,共20分)
I.(10分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下,测得浓度均为0.1mol/L的下列六种溶液的pH:

复分解反应存在这样一个规律:一种较强酸与一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2 ↑
若换个角度看,它同时还揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请你判断下列反应不能成立的是_______(填编号)。
A.CO2+H2O+2NaClO=Na2CO3+2HClO
B.CO2+H2O+NaClO=NaHCO3+HClO
C.CO2+H2O+C6H5ONa→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa→Na2CO3+2C6H5OH
E.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05mol/L的下列六种物质的溶液中,pH最小的
是___________(填编号),pH最大的是____________(填编号);
①HClO4 ②CH3COOH ③HCN ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其他的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②工业上将石灰乳与苦卤(主要溶质KCl、MgCl2)混合可得氢氧化镁固体
③蒸馏KCl和NaNO3混合溶液,首先析出NaCl晶体
请根据上述反应,总结出复分解反应发生的另一个规律:
_____________________________________________________________________.
将KI溶液与AgCl固体混合搅拌,固体变为黄色。该反应也遵循这一规律,请写出反应的化学方程式:____________________________________________________________.
19.(本题包括2个小题,共16分)
I.(3分)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制1 mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是______________________
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E.用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色;
 F.配制溶液和中和滴定的两个实验中,若在最后一次读数均俯视读数,则导致实验结果都偏大。
F.配制溶液和中和滴定的两个实验中,若在最后一次读数均俯视读数,则导致实验结果都偏大。
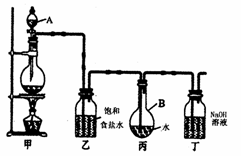
Ⅱ.(13分)现用如图所示的装置制取
较多量的饱和氯水并测定饱和氯水的pH。
回答有关问题:
(1)写出有关化学方程式。
装置甲:___________________________;
装置丁:___________________________。
(2)证明氯水已饱和的现象是____________
 ______________________________________
______________________________________
(3)制取结束时,装置丙的液体中含有的微
粒是___________(用微粒符号表示)
(4)有如下改进措施或建议,请作出评价:
①在装置乙和丙之间增加如图(a)所示的装
置,你认为有无必要? _________________。
②在装置丙的长导管下口处,接如图(b)所
示的多孔球泡,这样做的好处是:______
______________________________________
③若撤去装置乙,直接将装置甲和丙相连。这样做对实验结果的影响是:__________
___________________________________
18.(6分)
由短周期元素组成的A、B两种盐可发生下列变化.且B的焰色反应呈黄色(图中其它生成物未列出)

(1)A和B的混合物溶于水发生反应的离子方程式______________________________
(2)B、E两溶液混合反应时,可观察到的现象是_________________________________,
写出B→F反应的离子方程式_____________________________________________。
16.a mol FeS与b mol FeO投入到VL、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④[cV-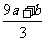 ]mol
]mol
A.①④ B.②④ C.②③ D.①③
第Ⅱ卷(非选择题,共52分)
下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA,ⅢA族的连接处。请用相应的化学用语回答下列问题:

(1)写出由e形成的两种带有相同电荷数阴离子的符号__________、__________。
(2)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离
子方程式________________。
(3)下左图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“l”代表Ar,
则其中柱形“8"代表________________________________________。(填化学式)

(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(上右图),序列“5”的氢化物
的名称是___________________.
15.某混合气体,可能含有N2、HCl、CO,把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化,再通过足量的Na2O2固体,气体体积减小,最后通过灼热的铜网,经充分反应后,气体体积又减小,但还有剩余气体,以下对混合气体组成的判断正确的是
A.一定没有N2,CO和HCl中至少有一种
B.一定有N2、HCl、CO
C.一定有N2和HCl,没有CO
D.一定有N2,CO和HCl中至少有一种
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com