
11.(10分)已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1)请写出并配平上述反应的化学方程式。 。
(2)此反应的还原剂是 ,它的氧化产物是 。
(3) 此反应的离子反应方程式可表示为: 。
(4)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
10. 将AsO
将AsO +2I-+2H+
+2I-+2H+ AsO
AsO +I2+H2O设计成右下图所示的电化学装置,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作:
+I2+H2O设计成右下图所示的电化学装置,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作:
甲组:向B烧杯中逐滴浓盐酸
乙组:向B烧杯中逐滴加入40%NaOH溶液
下列描述中,正确的是
A.甲组操作过程中,C2做负极
B.乙组操作过程中,C1上发生的电极反应为: 2I--2e-=I2
C.两次操作过程中,微安表(G)指针的偏转方向相反
D.甲组操作时该装置为原电池,乙组操作时该装置为电解池
班别 座号 姓名 评分
选择题答题表
9.500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为2 mol·L-1 B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为2 mol·L-1
8.工业上由二氧化锰制备高锰酸钾可分二步进行,第一步:二氧化锰与氢氧化钾共熔并通入氧气2MnO2+4KOH+O2 2K2MnO4+2H2O;第二步:电解锰酸钾溶液:2K2MnO4+H2O
2K2MnO4+2H2O;第二步:电解锰酸钾溶液:2K2MnO4+H2O  2KMnO4+H2↑+2KOH下列说法叙述正确的是
2KMnO4+H2↑+2KOH下列说法叙述正确的是
A 氧化性:KMnO4>K2MnO4>O2
B 根据上述过程,每生成1mol KMnO4共转移6mol电子
C 第二步电解时,KMnO4在阳极区生成
D 第二步电解时阴极周围pH减小
7.固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如右图所示:下列关于固体燃料电池的有关说法正确的是
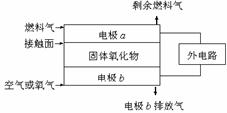 A.电极b为电池负极,电极反应式为O2+4e-=4O2-
A.电极b为电池负极,电极反应式为O2+4e-=4O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为
H2+2OH--4e-=2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为
C2H4+6O2--12e-=2CO2+2H2O
6.2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的 烯烃复分解催化剂。工业上冶炼钼的化学原理为:

则下列说法正确的是
A.MoS2煅烧产生的尾气可直接排空
B.MoO3是金属氧化物,能溶解于稀盐酸中
C.H2MoO4是一种强酸
D.用还原剂还原等质量的MoO3,消耗H2、CO和Al的物质的量之比为3:3:2
5. 2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示:下列说法正确的是
2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示:下列说法正确的是
A.左边为该电池的负极
B.该电池可在高温环境下使用
C.该电池负极反应为:H2 –2e-=2H+
D.该电池正极反应为O2+4e-=2O2–
4.物质的颗粒达到纳米级时,具有特殊的性质。如将单质铜制成“纳米铜”时,“纳米铜”具有非常强的化学活性,在空气中可以燃烧。下列叙述中正确的是
A.常温下,“纳米铜”比铜片的金属性强
B.常温下,“纳米铜”比铜片更易失电子
C.常温下,“纳米铜”与铜片的还原性相同
D.常温下,“纳米铜”比铜片的氧化性强
3.
 某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生
D.a点是负极,b点是正极
2.物质氧化性、还原性的强弱不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液 ;由于浓度不同而能发生不同氧化还原反应的是
A.①③ B.③④ C.① D.①③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com