
1.理解盐类水解的概念和导致盐类水解反应的本质原因,能熟练地写出盐类水解反应的化学方程式和离子方程式。
9.酸雨主要是燃烧含硫燃料时释放出SO2所造成的。现取一份雨水样品,每隔一定的时间测定其pH值,测定结果见附表:
附表:雨水样品pH值随时间的变化值
|
测试时间(h) |
0 |
1 |
2 |
4 |
8 |
|
雨水样品pH值 |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
试说明雨水样品pH值减小的原因:
。
第五章 电 离 平 衡
第三课时 盐类的水解
[考纲要求]
8.已知25℃时0.1mol·L-1醋酸溶液的pH约为3。向其中加入少量醋酸钠晶体, 待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释: 甲同学认为醋酸钠水解呈碱性, 增大了[OH-], 因而溶液的pH增大; 乙同学认为醋酸钠溶于水电离出大量醋酸根离子, 抑制了醋酸的电离, 使[H+]减小, 因此溶液的pH增大。你认为上述两种解释中 (“甲”或“乙”)正确。
(1)为了验证上述哪种解释正确, 继续做如下实验: 向0.1mol·L-1的醋酸溶液中加入少量下列物质 (填写编号), 然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
(2)若 (填“甲”或“乙”)的解释正确, 溶液的pH应 (填“增大”、“减小”或“不变”)。(已知: 25℃时, 0.1mol·L-1氨水的电离度为1.3%, 0.1mol·L-1醋酸的电离度为1.3%)
7. 25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好
中和,且已知Va<Vb和a=0.5b,请填写下列空白;
 (1)a值可否等于3(填“可”或“否”)_________,其理由是___________________
(1)a值可否等于3(填“可”或“否”)_________,其理由是___________________
(2)a值可否等于5(填“可”或“否”)________,其理由是____________________
(3)a的取值范围是_______________________________________。
6.在下列叙述中,能说明盐酸比醋酸酸性强的是
A. 将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多
B. 盐酸和醋酸都可用相应的钠盐与浓酸酸反应制取
C .相同pH值的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH值变化大
D. 相同pH值的盐酸和醋酸分别跟锌反应时,产生氢气的起始速度相等
5.室温下,在pH值都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-
离子浓度分别为A摩/升与B摩/升,则A和B关系为
A .A>B B .A=10-4 B C. B=10-4 A D. A=B
4.用水稀释0.1摩/升氨水时,溶液中随着水量的增加而减小的是
A.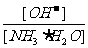 B.
B.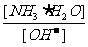 C.[H+]和[OH-]的乘积 D.OH-的物质的量
C.[H+]和[OH-]的乘积 D.OH-的物质的量
3.25°C时,某强酸溶液PH=a,体积为V1;强碱溶液PH=b,体积为V2;a+b=12,酸碱溶液
混合后PH=7,则V1和V2的关系为 ( )
A.V1=102V2 B.V2=102V1 C.V1=2V2 D.V2=2V1
2.室温时,若0.1mol/L的一元弱碱电离度为1%,则下列说法正确的是 ( )
A.该溶液的PH=11 B.该溶液的PH=3
C.加入等体积0.1mol/L HCl后,所得溶液PH=7
D.加入等体积0.1mol/L HCl后,所得溶液PH>7
1.PH=5的盐酸和PH=9的NaOH溶液以体积比11:9混合,混合液的PH值为
A. 7.2 B.8 C.6 D.无法计算
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com