
8.(2009重庆理综6)(6分)材料与化学密切相关,表中对应系错误的是 ( )
|
|
材料 |
主要化学成分 |
|
A |
刚玉、金刚石 |
三氧化二铝 |
|
B |
大理石、石灰石 |
碳酸钙 |
|
C |
普通水泥、普通玻璃 |
硅酸盐 |
|
D |
沙子、石英 |
二氧化硅 |
7.(2009四川理综6)(6分)开发新材料是现代科技发展的方向之一。下列有关材料的说法正确的是 ( )
A.氮化硅陶瓷是新型无机非金属材料
B.C60属于原子晶体,用于制造纳米材料
C.纤维素乙酸酯属于天然高分子材料
D.单晶硅常用于制造光导纤维
6.(2009广东理基28)(2分)下列说法正确的是( )
A.MgSO4晶体中只存在离子键
B.含Ca2+、Mg2+的水都是硬水
C.雾是气溶胶,在阳光下可观察到丁达尔效应
D.玻璃是氧化物,成分可表示为Na2O·CaO·6SiO2
5.(2009广东理基22)(2分)下列关于硅单质及其化合物的说法正确的是 ( )
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
A.①② B.②③ C.①④ D.③④
4.(2008广东化学23)(11分)硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主
要方法,生产过程示意图如下:
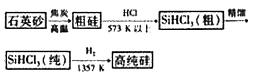
①写出由纯SiHCl3制备高纯硅的化学反应方程式 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式 ;H2还原SihCl3过程中若混02,可能引起的后果是 。
(2)下列有头硅材料的详法正确的是 (填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水混
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.普通玻璃是由纯碱、石灰石和石英砂的,其熔点很高
D.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释 。
3.(2007广东化学6)下列说法正确的是 ( )
A.硅材料广泛应用于光纤通讯
B.工艺师利用盐酸刻蚀石英制作艺术品
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.粗硅制备单晶硅不涉及氧化还原反应
2.(2008广东理基34)根据陈述的知识,类推得出的结论正确的是 ( )
A.镁条在空气中燃烧生成的氧化物是MgO,则纳在空气中燃烧生成的氧化物是Na2O
B.乙烯可使酸性高链子酸钾溶液褪色,则丙烯也可以使其褪色
C.CO2与SiO2化学式相似,则CO2和SiO2的物理性质也相似
D.金刚石的硬度大,则C12的硬度也大
1.(2007山东基本能力20)旅游洞穴一般是指供游人观览的喀斯特洞穴。多姿多彩的石钟乳、石笋、石柱、石花等碳酸钙沉积体是喀斯特洞穴中的主要景观。由于游人呼吸有时会使旅游洞穴中二氧化碳浓度大幅升高,可能造成的后果是( )
①抑制碳酸钙沉积的生长
②促进碳酸钙沉积体的生长
③使游客有憋闷的感觉
④使照明灯下的植物大量死亡
A.①③ B.②③
C.①④ D.②④
38.[化学--选修有机化学基础](15分)A~J有如下转化关系(其中部分产物已略去)。已知E分子中含有一个连有4个不同原子或原子团的碳原子;C分子核磁共振氢谱中共有4个吸收峰,其峰面积比为4:3:2:1;1mol F与足量的新制Cu(OH)2在加热条件下充分反应可生成2mol红色沉淀。分析并回答问题:
(1)A中含氧官能团的名称为________________________。
(2)C的结构简式为________________________。
(3)I的名称为________________________。
(4)H→I的反应类型为________________________。
(5)写出E→H反应的化学方程式________________________。
写出E→J反应的化学方程式________________________。
37.[化学--选修物质结构与性质](15分)下表为元素周期表的一部分。请回答下列问题:
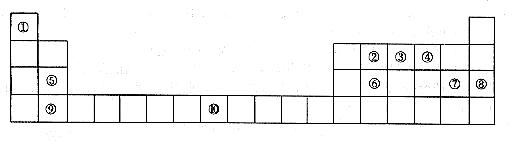
(1)上述元素中,属于s区的是________________________(填元素符号)。
(2)写出元素⑩的基态原子的电子排布式__________________________________________。
(3)元素第一电离能为⑤________________________⑨(填“大于”或“小于”)。
 (4)元素③气态氢化物的中心原子有________________________对弧对电子,其VSEPR模型为________________________;中心原子的杂化类型为________________________;该分子为________________________分子(填“极性”或“非极性”)。向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为________________________。
(4)元素③气态氢化物的中心原子有________________________对弧对电子,其VSEPR模型为________________________;中心原子的杂化类型为________________________;该分子为________________________分子(填“极性”或“非极性”)。向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为________________________。
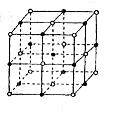
(5)元素⑦的钠盐晶胞结构如图所示,每个Na+周围与之距离最近的Na+的个数为________________________。若设该晶胞的棱长为a cm,阿伏加德罗常数的值为NA,则该钠盐的密度为________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com