
1.抛物线 的焦点坐标是 ( )
的焦点坐标是 ( )
A.(2,0) B.(- 2,0) C.(4,0) D.(- 4,0)
9.答案:(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)平衡压强(或使分液漏斗中的压强与圆底烧瓶中的压强相同,便于盐酸流下)
浓硫酸 使SiCl4冷凝。
(3)Al、P、Cl。
(4)①否;KMnO4溶液自身可作指示剂。 ②4.480%。
[解析]先理解各装置的用途。本实验目的是制备四氯化硅,根据题意,要用原料Cl2和粗Si。A装置为Cl2的制备装置(浓HCl与MnO2);B装置除HCl(可用饱和NaCl溶液);C装置(浓H2SO4)干燥Cl2(SiCl4遇水极易水解,所以D装置中不能有水蒸气);D装置发生Cl2与铁、铝、硼、磷的反应;E装置使SiCl4冷凝(也使升华后的AlCl3、FeCl3、PCl5凝结),BCl3(沸点12.8 ℃)以气体形式进入F装置;F装置防止空气中的水蒸气进入E装置。
(3)注意:Cl元素也是杂质。
(4) 5Fe - 5Fe2+ - MnO4-
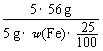 =
= 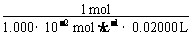
解得w(Fe) = 0.0448。
8.答案:A
[解析]本题考查生活中常见材料与化学的密切关系,要求考生了解常见物质的组成。刚玉和金刚石的成分分别是三氧化二铝和碳;大理石和石灰石的主要成分都是碳酸钙;普通玻璃和普通水泥都是常见的硅酸盐材料;沙子和石英的主要成分都是二氧化硅。故本题答案是A。
7.答案:A
[解析]C60属于分子晶体,B错;纤维素乙酸酯不是天然高分子材料,C错;制造光导纤维的原料是SiO2,D错。
6.答案:C
[解析]SO42 -离子内部存在共价键,A错。硬水指的是含较多Ca2+、Mg2+的水,较少时,不叫硬水,B错。玻璃的主要成分虽可用Na2O·CaO·6SiO2表示,但这仅仅是以氧化物的形式表示,它仍属于硅酸盐,D错。
5.答案:C
[解析]水晶的主要成分是SiO2,而非硅酸盐,②错。光导纤维的主要成分是SiO2,而非单质Si,③错。
3.答案:A
[解析]B项,工艺师利用HF刻蚀石英制作艺术品;C项,水晶项链的成分是SiO2,餐桌上的瓷盘是硅酸盐制品;D项,粗硅制备单晶硅先用Cl2氧化粗硅,再用H2还原SiCl4,这两个反应都是氧化还原反应。
|
②SiHCl3+3H2O====H2SiO3↓+3HCl↑+H2↑
氧气与氢气混合,可能引起爆炸;氧气可能会氧化SiHCl3
(2)BC
(3)现象:试管中有白色胶状沉淀生成,并且有刺激性气体生成。解释:Na2SO3和NH4Cl均能够水解,二者相互促进,Na2SiO3水解生成H2SiO3,NH4Cl水解产生NH3。
[解析]本题考查学生对质量守恒定律的理解,考查学生对盐类水解、单质和化合物主要性质的掌握;考查学生从信息中准确提以实质性内容,并与已有知识整合,重组为新知识的能力;考查学生用正确的化学术语做出解释的能力。
(1)①根据给定的反应物和生成物写出化学方程式,注意反应条件和配平。
②写出反应物和给出的生成物H2SiO3和HCl,用原子守恒法找出另一种生成物为H2,并配平。
(2)A项水泥是硅酸盐;B、C选项回忆课本硅的化合物的用途可知,两项说法都正确。D项玻璃是混合物没有固定熔点;E项盐酸和硅不反应。
2.答案:B
[解析]Mg在空气中燃烧生成MgO,而Na燃烧生成Na2O2;乙烯和丙烯是同系物,都能使高锰酸钾溶液褪色;CO2与SiO2化学性质相似,但由于晶体类型不同,所以物理性质上有很大差异;金刚石与C60晶体类型不同,前者是原子晶体,有很高的硬度和熔沸点,后者是分子晶体,其硬度、熔沸点都不会高。
1.答案:A
[解析]CO2的浓升高,使Ca(HCO3)2的量增大,抑制CaCO3沉积体的生长,也使O2的浓度降低,让游客有憋闷的感觉。
9.(2009浙江理综28)(15分)单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
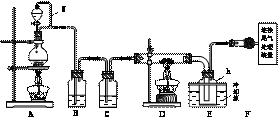
相关信息如下:
a.四氯化硅遇水极易水解;
b.铁、铝、硼、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
|
物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
|
沸点/℃ |
57.7 |
12.8 |
- |
315 |
- |
|
熔点/℃ |
-70.0 |
-107.2 |
- |
- |
- |
|
升华温度/℃ |
- |
- |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式 。
(2)装置A中g管的作用是 ;装置C 中的试剂是 ;装置E中的h瓶需要冷却理由是 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
5Fe2++MnO4- +8H+ = 5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
②某同学称取5.000 g残留物,预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是 。
高考真题答案与解析
化 学
[考点16]无机非金属材料的主角 硅及碳族元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com