
3.根据热化学方程式:S(s)+O2(g)=SO2(g);△H=-297.23kJ/mol。分析下列说法正确的是
A.S(g)+O2(g)=SO2(g);△H=-Q。Q的值不小于297.23
B.S(g)+O2(g)=SO2(g);△H=-Q。Q的值不大于297.23
C.1molSO2的总能量小于1molS和1molO2能量总和
D.1molSO2的总能量大于1molS和1molO2能量总和
2.在2004年至2005年中,化学工作者和社会各界都一直关注食品安全问题,如“苏丹红1号”、“食品添加剂”、“火腿肠中保鲜剂”、“油炸薯类食品中的丙烯酰胺”等等。下列关于食品安全方面的说法正确的是
A.“苏丹红1号”的结构式为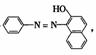 属于甲苯的同系物,能使酸性KMnO4溶液褪色;
属于甲苯的同系物,能使酸性KMnO4溶液褪色;
B.高温油炸食品中含有一定量的CH2=CH-CO-NH2(丙烯酰胺),该物质能在一定条件下发生缩聚反应生成高分子化合物;
C.食品添加剂中种类很多,其中的一种为苯甲酸钠,它是苯的同系物的一种所对应的钠盐;
D.火腿肠中保鲜剂通常用NaNO2,起抗氧化作用而达到保鲜的目的。
1.我国科学家在1993年首次利用超真空扫描隧道显微镜技术,在一块晶体硅(由硅原子构成)的表面通过探针拨出硅原子写下了“中国”两字(如下图)。下列说法中正确的是
A.在上述操作中没有任何变化 B.在上述操作中发生了物理变化
C.在上述操作中发生了化学变化 D.此技术说明在化学变化中原子可以再分

8、A、B、C、D是四种常见的单质,A、B为金属;C、D常温下是气体,且D为黄绿色气体。甲、乙、丙为常见的化合物,甲物质具有磁性。它们之间有如图18的转化关系:
|


请回答下列问题:
(1)B与甲反应的化学方程式是________________________________ __________。
B与NaOH溶液反应的离子方程式是____________________________________________。
(2)含有B的阳离子的溶液与乙溶液反应得到一种白色沉淀,该反应的离子方程式_____。
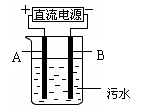 (3)实验室检验丙溶液中所含金属阳离子的操作方法和现象是
。
(3)实验室检验丙溶液中所含金属阳离子的操作方法和现象是
。
|
阳极的电极反应分别是 、
2H2O-4e-=4H++O2↑;阳极区生成沉淀的离子方程式是______ 。
7、短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1︰1的离子化合物A,X与Z能形成原子个数比为1︰1的共价化合物B,它们之间能实现如图17所示转化(部分产物已略去):
|
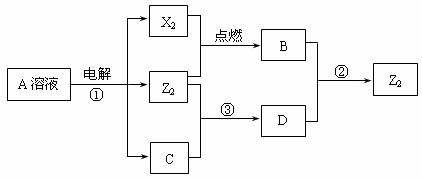
(1)Y在周期表的位置是_____________________;Z2的电子式是____________________。
(2)反应①的化学方程式是__________________________________________________。
(3)D溶液呈碱性的原因是(用离子方程式表示)_________________________________;
D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原
理来制备纯净、干燥的Z2,仪器装置如图18所示(夹持固定装置的仪器已略去)。
|
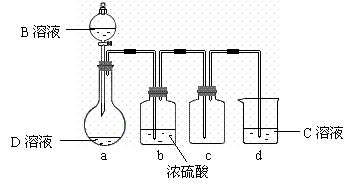

I、写出反应②的离子方程式____________________ ____________。
II、上述实验装置不够完善,改进方法是 。
 (4)Z2跟C在常温时发生反应③,在加热条件下发生的反应是
(4)Z2跟C在常温时发生反应③,在加热条件下发生的反应是
3Z2+6C 5A+YZO3+3H2O ,
3mol Z2与足量的C溶液反应,转移电子的物质的量n(e-)的取值范围是________________。
6、(08年北京延庆一模)A、B、C三种物质的转化关系如图所示(部分产物已略去)。A是常见的金属单质,通常状况下Y单质是气体,A在Y中燃烧生成棕黄色烟,反应①、②均在水溶液中进行。
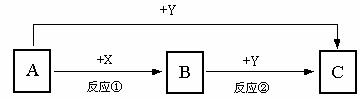
请回答:
(1)实验室可用X的浓溶液制取Y,反应的化学方程式为 ;
若反应中转移0.05 mol电子,则生成Y的体积在标准状况下为 。
(2)向B溶液中滴加NaOH溶液并在空气中放置一段时间,此过程中的实验现象为 ,其中涉及到氧化还原反应的化学方程式为 。
(3)A与过量的X溶液反应生成B的同时还有某种气体产生,为了减缓反应速率而不影响该气体的总量,可向X溶液中加入适量的 (选填字母)。
a.CH3COONa(固) b.CuSO4(固) c.KNO3溶液 d.水
(4)C溶液与草酸(H2C2O4)反应,得到澄清溶液,同时生成一种能使石灰水变浑浊的气体,此反应的离子方程式为 。
(5)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了右下图所示的实验。
①可通过观察
的现象来定性地得出结论。
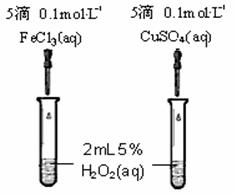 ②有A同学提出将CuSO4改为CuCl2更为合理,其理由是
。
②有A同学提出将CuSO4改为CuCl2更为合理,其理由是
。
若不采用A同学的改进方案,你认为还可以如何改进?
。
5、原子序数从小到大排列的四种短周期元素W、X、Y、Z,四种元素的原子最外层电子数之和等于12;W是原子半径最小的元素;由X 、Y元素可组成非极性分子A,A在常温下为气体; 由Y 、Z元素按原子个数比1:1可组成离子化合物B;A与B反应可生成Y2气体。
(1)元素W是: ;写出B的电子式
(2)写出金属镁在A中燃烧的化学方程式:
该反应属于 (填写序号)
a 置换反应 b 化合反应 c 分解反应 d 复分解反应 e 氧化还原反应
(3)C是由X 、Y 、Z三种元素组成的盐,C能与盐酸反应生成A,则C的化学式是
(4)D是由W、X 、Y 三种元素按原子个数比为1 :1 :2组成的一种酸,D在常温下为固体。已知在含1molD的水溶液中加入1molC恰好反应生成1molA。则D的化学式
是 ;D能使高锰酸钾酸性溶液褪色,说明D具有 性。
(5)某学习小组用下图所示装置(夹持仪器已略)检验D与浓硫酸混合加热发生分解反应的产物。
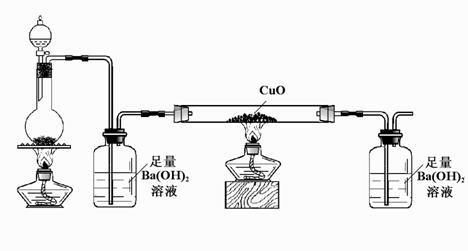
①实验时盛放D的仪器是
②实验时两个广口瓶中均产生白色沉淀;玻璃管中固体变为红色。写出D分解反应的
化学方程式:
③实验中产生的尾气应如何处理:
4、A~G为中学常见的化合物,它们之间有如图所示的转化关系(反应条件及部分产物已略去)。A为绿色粉末,含H、C、O、Cu四种元素。常温下D为无色无味气体,B为黑色粉末,E能发生银镜反应。
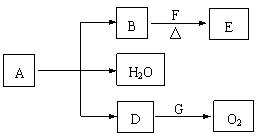
请回答:
(1)D跟G反应的化学方程式为_____________________________________;
(2)F中一定含有的官能团的名称为_______________________; (3)某课外小组同学设计了下列实验装置,通过测定某些装置中试剂的质量变化,探究A 中各元素的质量关系。
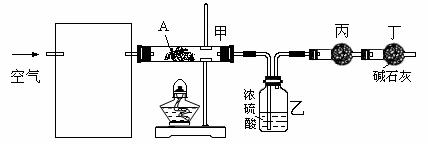
① 为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
② 向装置中鼓入空气的目的是____________________________________________;
丙装置中药品的名称为___________,实验时,该药品未见明显变化,证明________;
③ 如何判断A已完全分解?________________________________________________________。
④ 更精确的测定得出如下数据:A受热后完全分解,固体由8.0 g变为6.0 g,装置乙增重0.90 g。写出A的化学式(表示为碱式盐):________________________。
3、铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[方案一]
[实验方案]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是
[实验步骤]
(1)称取5.4g铝镁合金粉末样品,溶于VmL 2.0mol/L NaOH溶液中,充分反应。则NaOH溶液的体积V ≥ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(填“偏高”、“偏低”或“无影响”)。
[方案二]
[实验方案]将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01 105Pa)的体积。
105Pa)的体积。
[问题讨论]
(1)同学们拟选用下列实验装置完成实验:
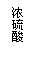
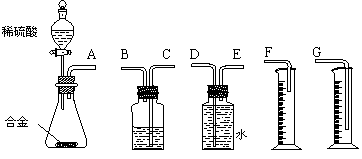
①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因。
。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
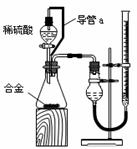 D.视线与凹液面的最低点水平,读取量筒中水的体积
D.视线与凹液面的最低点水平,读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
①装置中导管a的作用是
。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_____mL。
2、氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下
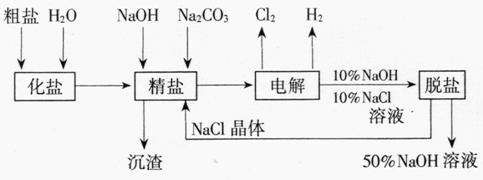
图14-4
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连的电极附近,溶液pH (选填“不变”“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 、 。
(3)如果粗盐中SO2-4含量较高,必须添加钡试剂除去SO42,该钡试剂可以是 (选填a,b,c多选扣分)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42,加入试剂的合理顺序为 (选填a、b、c多选扣分)。
a.先加NaOH,后加Na2CO3,再加钡试剂 b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com