
5.下列关于细胞工程的叙述正确的是 ( )
A.植物细胞工程中,融合叶肉细胞时,应先去掉细胞膜,制备原生质体
B.克隆羊“多莉”的培育技术主要包括核移植和胚胎移植两方面
C.植物细胞工程中,叶肉细胞经再分化过程可形成愈伤组织
D.单克隆抗体制备过程中,采用不经免疫的B淋巴细胞与骨髓细胞融合,从而获得杂交瘤细胞
4. 下列关于几种微生物的营养代谢和生长繁殖的描述,正确的是( )
A.根瘤菌通过生物固氮,制造了含氮养料和含碳有机物
B.接种到培养基上的青霉菌,进入对数期能大量积累有毒素
C.培养液中溶氧量的变化,会影响酵母菌的生长繁殖和代谢途径
D.用32P标记的噬菌体感染细菌,在新形成的噬菌体中都能检测到32P
3.下列各项中,能够形成氨的是( )
①生物固氮 ②微生物分解动植物遗体 ③硝化细菌的硝化作用
A.①③ B.②③ C .①② D.①②③
2.下列关于免疫的叙述,正确的是( )
A.效应B细胞不具有识别抗原的作用 B.抗体的分泌属于体液免疫的感应阶段
C.抗体能够与抗原特异性的结合,杀灭抗原 D.只有效应B细胞具有分泌蛋白的功能
1.下列过程发生在内环境中的是( )
A.葡萄糖脱氢分解成丙酮酸 B.神经递质与受体结合
C.食物中蛋白质经消化被分解成氨基酸 D.胰岛细胞合成胰岛素
14.答案:(1)水泥;△H1-3△H2+18△H3(2) ,Na5P3O10,(3)+1;2Ni2+ + 1H2PO2-+ 1H2O → 2 Ni+ +1H2PO3-+ 2 H+(4)化学镀中镀件直接与电解质溶液接触反应;电镀通过外加电流,在镀件外形成镀层 ;化学镀是利用化学腐蚀反应;电镀是利用电解池,外加电流进行氧化还原反应 ; 装置简便,节约能源,操作简便 。
,Na5P3O10,(3)+1;2Ni2+ + 1H2PO2-+ 1H2O → 2 Ni+ +1H2PO3-+ 2 H+(4)化学镀中镀件直接与电解质溶液接触反应;电镀通过外加电流,在镀件外形成镀层 ;化学镀是利用化学腐蚀反应;电镀是利用电解池,外加电流进行氧化还原反应 ; 装置简便,节约能源,操作简便 。
[解析](1)①由方程式可以看出副产物矿渣应该是CaSiO3(s),结合炼铁我们不难得出答案是制水泥。
②运用盖斯定律,反应1-反应2×3+反应3×18=总反应,则△H=△H1-3△H2+18△H3
(2)结合题意三聚磷酸钠(俗称“五钠”)可知产物三聚磷酸应含有五个羟基,即三个
磷酸分子之间有三个羟基相互反应脱去两个水分子,所以三聚磷酸的结构式为
 ,三聚磷酸钠的化学式为Na5P3O10。
,三聚磷酸钠的化学式为Na5P3O10。
(3)①因为Na、H的化合价为+1,O为-2,所以由化合价代数和为0可得P的化合价为:+1。
②由得失电子数目守恒(2-1)×2=(3-1)×1,可知Ni2+ 和Ni+的化学计量数为2,H2PO2-和H2PO3-的化学计量数为1,再由电荷守恒2×2-1=2×1-1+2×1,可知H+在方程式的右边,H2O在方程式的左边,化学计量数分别为2和1。即总方程式为:
2Ni2+ +1H2PO2-+ 1H2O→2Ni+ +1H2PO3-+ 2 H+
③比较化学镀与电镀应该从反应环境和条件以及反应实质和产物方面去分析归纳问题,从方法上分析,电镀是利用电解原理通过外加直流电源,在镀件表面形成的镀层,镀层一般只有镍,而化学镀是利用氧化还原反应镀件直接与电解质溶液接触,在塑料镀件表面沉积镍-磷合金,这是两者的不同;从原理上分析,无论电镀还是化学镀均有电子的转移,均是利用了氧化还原反应,这是两者的相同点,不同点是化学镀用的是化学反应,而电镀用的是电化学;很明显化学镀装置简单,而且不需要消耗电能,装置简单、耗能少、操作简便应该是化学镀优于电镀的。
13.答案:(8分)
(1)4CmHn+(4m+n)O2=4mCO2+2nH2O(2分) 化学 热(2分)
(2)SO2(2分)
(3)2NOx+2xCO N2+2xNO2(2分)
N2+2xNO2(2分)
[解析](1)汽油燃烧的化学方程式为:
4CmHn +(4m+n)O2=2nH2O + 4mCO2 ,燃烧过程为化学能转化为热能。
(2)精炼汽油可以减少其中硫的含量从而减少二氧化硫的排放大。
(3)这和(1)一样,也是属于对未知物反应方程式的配平:2NOx+
2xCO  N2 + 2x CO2
N2 + 2x CO2
12.答案:
(1)Cu、O
(2)b、c
(3)2Fe3++2I-=2Fe2++I2
S2O82-+2Fe2+=2SO42-+2Fe3+(离子方程式不配平不扣分)
(4)a:稀硫酸、KMnO4溶液
b:稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色
[解析](1)若CuFeS2中Fe的化合价为+2,则Cu化合价为+2,S化合价为-2,分析化学方程式两边元素化合价的变化可知,化合价降低的元素被还原,有Cu和O元素。关于SO2的吸收问题,一是不能高空排放,因为这样做,没有从根本上解决污染问题;二是不能用浓硫酸吸收,因SO2难溶于浓硫酸。只有变废为宝,才能符合“绿色化学”的概念,答案选b、c.
(2)此题要从催化剂的本质出发,作为催化剂的物质要参与有关反应,但后来的反应必须又生成了催化剂。本题要求写出表示Fe3+作催化剂的反应,因此,首先Fe3+要参与反应,即有反应2Fe3++2I-=2Fe2+ +I2,生成的Fe2+又被S2032-氧化生成了Fe3+。此题若要求写出Fe2+对上述反应的作催化剂的话,就应写成如下方程式:S2082-+Fe2+=2SO42-+2Fe3+,2Fe3++2I-=2Fe2+ +I2,虽是二个相同反应方程式,由于二者的前后顺序的颠倒,却产生了本质的区别。
(3)此题考查是混合物的分离与提纯及常见离子的鉴别。因Al2O3溶于酸后生成了Al3+,Al3+又能与过量NaOH的反应生成可溶性的钠盐(NaAlO2),然后将溶液中的难溶物Fe(OH)3沉淀过滤出来,将沉淀洗涤、干燥、煅烧得Fe2O3。故除去Al3+的离子方程式是Al3++4OH-=AlO2-+2H2O。要证明炉渣中含有FeO的方法,最好利用Fe2+的还原性,先将混合物溶于过量的稀硫酸中(FeO→Fe2+),然后滴入KMn04溶液,观察其溶液是否褪色。注意所用酸不能是硝酸或盐酸,因硝酸会将Fe2+氧化成Fe3+;盐酸会还原KMn04溶液而使之褪色,干扰了Fe2+的检验。
11.答案:(11分)(1)Cu2S (2)Cu2O,Cu2S
(3)形成酸雨,会对植物和建筑物造成严重损害 硫酸 硫酸铵 电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液。阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu2+进入溶液中Cu-2e- === Cu2+;阴极上发生还原反应,Cu2+得到电子在阴极上析出Cu单质,Cu2++2e- === Cu,从而达到精制Cu的目的 (5)A D
[解析]
(1)上表所列铜化合物中,铜的质量百分含量最高的是Cu2S
解释:CuFeS2:34.8% ;Cu5FeS4:63.5% ;Cu2S:80% ;CuCO3·Cu(OH)2:57.6%
(2) 反应的氧化剂是Cu2O,Cu2S
解释:Cu2O,Cu2S的Cu由+1被还原为0价,作氧化剂;Cu2S的S有-2价被氧化为+4价,作还原剂。
(3) SO2尾气直接排放到大气中造成环境污染的后果是形成酸雨。处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称硫酸,硫酸铵。
解释:处理SO2尾气一般为循环制备硫酸,和用Ca(OH)2 或氨水吸收,可得到CaSO4和(NH4)2SO4等有价值的化学品。
(4) 简述粗铜电解得到精铜的原理:电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液。阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu2+进入溶液中Cu- 2e- == Cu2+;阴极上发生还原反应,Cu2+得到电子在阴极上析出Cu单质,Cu2++ e- == Cu,从而达到精制Cu的目的。
(5) A.D
解释:稀盐酸可以同Cu(OH)2与CuCO3反应,而且稀盐酸不能于Cu反应。所以稀盐酸可以除铜器表面的铜绿(CuCO3·Cu(OH)2),A正确。
铜表面不能形成致密氧化膜;铜和浓硫酸在常温下是反应的,生成硫酸铜、SO2和水,反应很慢,反应过程中放热,随着反应的进行,速率会越来越快的,所以不能用铜制容器装浓硫酸,B错误。
因为Fe比Cu活泼,所以Fe-Cu形成的原电池中,Fe作负极,更容易被氧化生绣,C错误。
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末,只有旧键的断裂,没有新键的形成(CuSO4·5H2O中,H2O与Cu2+有配位键),故不属于化学变化,只有物理变化;CuSO4可用作消毒剂,但与前者没有因果关系,D正确。
综上所述,答案选AD。
10.答案:(1)3 6 2 1 6 (2)N2 Si3N4
(3)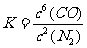 (或
(或 )
)
(4)小于 减小 (5)逆 (6)6
 [解析](1)利用观察法配平或利用氧化还原反应中的电子守恒来配平。配平后的化学方程式为3SiO2 +6C+2N2Si3N4 + 6CO。
[解析](1)利用观察法配平或利用氧化还原反应中的电子守恒来配平。配平后的化学方程式为3SiO2 +6C+2N2Si3N4 + 6CO。
(2)分析各物质的化合价变化情况:C元素由0价升高为+2价,在反应中作还原剂被氧化;N元素的化合价由0价降低为-3价,在反应中作氧化剂被还原。因此,此反应的氧化剂为N2,还原产物为Si3N4。
(3)因SiO2、C、Si3N4均为固体,只有N2和CO为气体,存在平衡浓度(或平衡分压),因此根据化学平衡常数的表达式可以得出此反应的平衡常数表达式为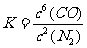 或
或 。
。
(4)放热反应的焓变△H<0,升高温度,此平衡向左移动,使[CO]减小、[N2]增大,因此平衡常数K值减小。
(5)由于此反应的正反应为气体体积增大的反应,因此增大压强,此平衡将向逆反应方向移动。
(6)根据同一反应在同一时间段内,各物质的反应速率之比等于各物质在化学方程式中对应的计量数之比。则有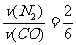 ,所以v(N2)=
,所以v(N2)=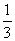 v(CO)=
v(CO)=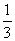 ×18mol·L-1·min-1=6mol·L-1·min-1。
×18mol·L-1·min-1=6mol·L-1·min-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com