
4.下列各组实验均不需要水浴加热的是( )
①由苯制溴苯 ②制硝基苯 ③制乙酸乙酯 ④由酒精制乙烯
⑤制酚醛树脂 ⑥银镜反应
A. ①③⑤ B. ①③④ C. ②③⑤ D. ②⑤⑥
3. 分子式C4H9Br的卤代烃发生消去反应的产物有两种,则其结构简式为( )
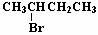 A. CH3CH2CH2CH2Br
B.
A. CH3CH2CH2CH2Br
B.
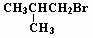 C.
D. (CH3)3CBr
C.
D. (CH3)3CBr
2.质量为ag的铜丝,在空气中灼热变黑,趁热放入下列物质中,铜丝变红,质量仍为ag的是: ( )
A、盐酸 B、CH3COOH C、HNO3 D、C2H5OH
1.下列反应中,属于消去反应的是: ( )
A、乙烷与溴水的反应 B、乙醇与浓硫酸共热到140摄氏度
C、氯苯与NaOH水溶液混合加热 D、溴丙烷与KOH的乙醇溶液混合加热
15.答案:(1)0.25。 (2)1.64。
(3)不符合 因吸收后烟气总体积减小,NOx含量仍超过400 mg/m3。
(4)(i) n(NO)×30 g·mol-1+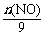 ×46 g·mol-1 =
×46 g·mol-1 = 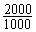 g
g
解得n(NO) = 0.057 mol
设被HNO3氧化的NO的物质的量为y,有:
NO+2HNO3  3NO2+H2O
3NO2+H2O
y 2y 3y
满足: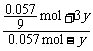 =
=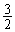
得 y = 0.0176 mol n(HNO3) = 2y = 0.035 mol
(ii)经HNO3氧化后,
n(NO)后 = 0.057 mol-0.0176 mol = 0.0394 mol
n(NO2)后 = 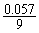 mol+3×0.0176 mol =
0.0591 mol
mol+3×0.0176 mol =
0.0591 mol
先发生反应①,之后再发生反应②,所以有:
n(NaNO2) = 2n(NO)后+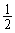 [n(NO2)后-n(NO)后] = 0.0887 mol
[n(NO2)后-n(NO)后] = 0.0887 mol
m(NaNO2) = 0.0887 mol×69 g·mol-1×90% = 5.5 g
[解析](1)1 L烟气中最高允许含NO质量为0.4 g×0.85 = 0.34 g
其体积为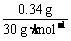 ×22.4 L·mol-1 = 0.25 L
×22.4 L·mol-1 = 0.25 L
(2)利用物质的量浓度与质量分数的换算公式求解:
c(Na2CO3) =  = 1.64 mol·L-1
= 1.64 mol·L-1
(3)吸收率为80%,1 m3废气被碳酸钠溶液吸收后,剩余NOx为400 mg,吸收后烟气总体积减小,所以吸收后烟气中NOx的含量仍超标。
版权所有:()
14.答案:(1)三、II A、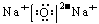 或
或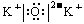 。
。
(2)水分子之间存在氢键,比硒化氢的分子间作用力强。
(3)4NH3+3O2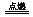 2N2+6H2O(3分)
2N2+6H2O(3分)
(4)Mg3N2+8HNO3 = 3Mg(NO3)2+2NH4NO3。
(5)2。
[解析]“B与冷水缓慢反应,与沸水迅速反应,放出氢气”,这是单质镁的性质,由此推知A是N2,D是Mg3N2。再根据“C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀”推知C是Na2O2,H是O2,G是NaOH,J是H2O,能够跟O2反应生成N2的I应该是NH3,L是NO,M是NO2,N是硝酸,O是硝酸铜。最后确定F是硝酸铵,E是硝酸镁,K是硝酸钠。做出正确推断后,相关问题就迎刃而解了。
(3)氨在无催化剂存在时在纯氧中燃烧生成N2。
(5)Na2O2、NO2与水的反应都是歧化反应,Na2O2、NO2既做氧化剂又做还原剂。
13.答案:(1)固体NH4Cl和Ca(OH)2; 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O[其他合理答案也给分]。
CaCl2+2NH3↑+2H2O[其他合理答案也给分]。
(2)碱石灰(或CaO); 除去NH3流中的水蒸气。
(3)黑色粉末部分逐渐变为红色; 2NH3+3CuO N2+3H2O+3Cu。
N2+3H2O+3Cu。
(4)出现无色液体; 氨水;
用红色石蕊试纸检验,试纸变蓝;用无水硫酸铜检验,无水硫酸铜变蓝。
[解析]理解实验原理是解实验题的前提和根本。从本题的目的可推出:A处应产生NH3[用NH4Cl和Ca(OH)2];B处应干燥NH3(用碱石灰);C处应是CuO,发生与NH3的反应:2NH3+3CuO N2+3H2O+3Cu;D处使物质冷却(H2O液化,过量氨溶于H2O);E处收集N2。
N2+3H2O+3Cu;D处使物质冷却(H2O液化,过量氨溶于H2O);E处收集N2。
清楚了这些原理,其设问就迎刃而解了。
要特别注意实验题易出现的问题:回答不完整。如(4)中物质的检验,若只考虑检验NH3,或只考虑检验H2O,都是不完整的。
12.答案:(1)3 mo/L的稀硝酸 浓硝酸 氢氧化钠溶液。
(2)通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内。
(3)Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O。
(4)将NO2转化为NO; 3NO2+H2O = 2HNO+NO。
(5)装置③中液面上方的气体仍为无色,装置④中液面上方的气体由无色变为红棕色。
(6)a c d。
[解析]本题主要考查HNO3的性质、化学基本实验设计和评价能力。
先根据装置特点和实验目的来分析装置中各盛放什么物质:装置④盛放浓HNO3以验证HNO3氧化NO成NO2,NO2由装置⑥(NaOH)来吸收;装置③应盛放稀硝酸以验证稀HNO3不能氧化NO,NO不能被NaOH吸收,所以由装置⑤来收集。②应是水,以使NO2变为NO。
(2)由于装置中的空气能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,之后要将装置⑤中导管末端伸入倒置的烧瓶内,以防止反应产生的NO气体逸出。
(5)NO被氧化后生成红棕色的NO2,所以可从气体是否变为红棕色来证明浓、稀HNO3是否氧化了NO。
(6)方法一:将溶解的NO2赶走(a、c方案)再观察颜色是否变化;方法二:配制一饱和Cu(NO3)2溶液与该溶液比较颜色;方法三:在饱和的纯Cu(NO3)2溶液中通入NO2气体(方案d),观察颜色是否变化;方法四:稀释该溶液(方案c),但该法使Cu(NO3)2稀释的同时也与NO2反应,所以没有可比性。
11.答案:A
[解析]确定氮元素的还原产物是N2是解题的关键:气态NxOy中氮元素降价,由于NH3能被CuO氧化(2NH3+3CuO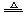 3Cu+N2↑+3H2O),所以氮的还原产物为N2。再根据22.4→11.2及2NxOy→xN2,可得x = 1,只有A项符合。
3Cu+N2↑+3H2O),所以氮的还原产物为N2。再根据22.4→11.2及2NxOy→xN2,可得x = 1,只有A项符合。
[点评]本题主要考查气体摩尔体积、阿伏加德罗定律等知识,题目较为老套,而且这种题目在若干年前就已经经常出现了。
10.答案:B
[解析]可燃物着火需要两个条件,一是达到着火点,二是有足够的空气。氯化铵分解吸热,使环境温度降低,达不到幕布的着火点,且分解产生的NH3和HCl可隔绝空气使幕布不易燃烧。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com