
15.(10分)A-H是中学化学的常见物质,其中E、F、G是单质,B的化学式是E2F3,它们有如下图转化关系:
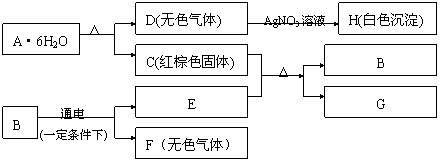

试回答下列问题:
(1)A、F、H的化学式分别是 、 、 。
(2)C+E反应的化学方程式是 。
(3)若由A生成的C与由B生成的E恰好完全反应,则A与B的物质的量之比为 。
(4)简要说明A·6H2O可转变为C和D的原因是 。
14.(12分)纳米材料在绝大多数同学眼里都非常神秘。某化学学习小组决定通过查阅有关资料,自己动手实验,制备纳米铁粉。
[实验原理]
(1)用硫酸亚铁、草酸两溶液制备草酸亚铁晶体(溶解度较小)。该反应的化学方程式是 。
(2)焙烧草酸亚铁晶体:FeC2O4·2H2O Fe+2CO2↑+2H2O↑
Fe+2CO2↑+2H2O↑
[操作步骤]
(1)草酸亚铁晶体的制备

① 现有烧杯、玻璃棒、药匙、滤纸、托盘天平、FeSO4、草酸等实验用品,为配制上述两溶液,缺少的仪器有 。
② 若配制的FeSO4溶液略呈黄色,可能的原因是 。
③ 检验草酸亚铁晶体是否洗净的方法是 。
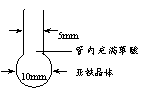 (2)纳米铁粉的制备
(2)纳米铁粉的制备
将一根长度约为12 cm-14cm的玻璃管在酒精喷灯上烧制成如 图所示形状,向其中加入黄色草酸亚铁晶体。再将管口部分加热拉细,然后在酒精喷灯上均匀加热。当草酸亚铁粉末受热完全变黑,立即将管口拉细的部分放在火焰烧熔封闭,这样便得到了高纯度的纳米铁粉。
① 实验中分解产生CO2所起的作用是 。
② 指导老师提醒同学们应准确把握玻璃管的烧熔封闭时间。你认为烧熔过早、过晚的后果是 。
13.(12分)氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
(1)制备氧化铜
|
|
|
||||||




 工业CuSO4
CuSO4溶液 CuSO4·5H2O …… CuO
工业CuSO4
CuSO4溶液 CuSO4·5H2O …… CuO
① 步骤I的目的是除不溶性杂质。操作是 。
② 步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热;当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是
。
③ 步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是
,然后过滤,水浴加热烘干。水浴加热的特点是 。
(2)探究氧化铜的性质
① 取A、B两支试管,往A中先加入适量CuO粉末,再分别向A 和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡。结论是 。
② 为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器有:
。
12.(12分)某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:
一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;
二是发生双水解反应: 2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。
为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
[实验Ⅰ]学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,作者设计这个实验的目的是 。
[实验Ⅱ]取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色“液体”是 ,向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 ;将该溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生血红色现象的离子方程式是 。
[实验Ⅲ]换用稀释的FeCl3和Na2SO3溶液重复实验,、Ⅲ产生的现象与实验Ⅱ完全相同。由上述实验得出的结论是 。
[实验Ⅳ]若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是_______________________________________________。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
①___________________________________;②________________________________。
11.(12分)氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸的哪种粒子(H2O,H+,SO42-)能使氧化铜溶解。请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完
成这次探究活动。
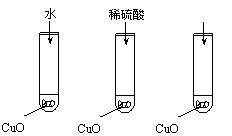 (1)某同学提出的假设是
(1)某同学提出的假设是
;
(2)通过实验Ⅰ可以证明
;
 (3)要证明另外两种粒子能否溶解氧化铜,还需要 进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认为:在Ⅲ中先加入
,再加入
。
(3)要证明另外两种粒子能否溶解氧化铜,还需要 进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认为:在Ⅲ中先加入
,再加入
。
(4)探究结果为
。你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是 。
10.向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL l moL/L的盐酸;恰好使混合物完全溶解并放出标况下224mL气体。向所得溶液中加入KSCN溶液无血红色出现,若用足量的CO在高温下还原相同质量的此混合物,能得到单质铁的质量为
A.11.2g B.2.8g C.5.6g D.无法计算
9.当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀又逐渐溶解成为深蓝色的溶液,向深蓝色溶液中通入SO2气体,又生成了白色沉淀:将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下列描述正确的有
A.Cu2+和Ag+相似,能与NH3结合生成铜氨络离子
B.白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应
C.白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下发生了自身氧化还原反应
D.反应过程中消耗的SO2与生成的SO2的物质的量相等
8.自然界中存在一种尖晶石,化学式为MgAl2O4,它透明色美,可作为宝石。已知该尖晶石中混有Fe2O3。取一定量样品5.4g,恰好与一定浓度100ml盐酸反应,盐酸浓度可能是
A.2.2 mol/L B.2.8 mol/L C.4.3 mol/L D.4.9 mol/L
7.水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32–+O2+xOH– =Fe3O4+S4O62–+2H2O,下列说法正确的是
A.硫元素被氧化,铁元素被还原 B.Fe2+、S2O32-都是还原剂
C.x=2 D.每生成1mol Fe3O4,则转移电子数为3mol
6.把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
A.SO2 B.Cl― C.Fe3+ D.NO3―
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com