
1.电解各类电解质溶液(惰性电极)的情况是归纳见下表:
|
电解类型 |
实例 |
阴极 |
阳极 |
电解反应式 |
溶液pH |
恢复 |
|
电解水 |
H2SO4 |
|
|
|
|
加H2O |
|
NaOH |
|
|||||
|
NaNO3 |
|
|||||
|
电解自身 |
HBr |
|
|
|
|
通入HBr气体 |
|
CuCl2 |
|
|
|
|
加入CuCl2固体 |
|
|
生碱析氢 |
NaCl |
|
|
|
|
通入HCl气体 |
|
生酸放氧 |
CuSO4 |
|
|
|
|
加入CuO固体或CuCO3固体 |
3.电解时电极产物的判断
(1) 阳极产物判断
首先看电极材料,活泼金属做电极则金属失电子被氧化。如果是惰性电极则是溶液中易失电子的阴离子失电子被氧化。阴离子失电子能力:S2->I->Br->Cl->OH->NO3->SO42->F-
(2) 阴极产物判断
根据阳离子放电顺序进行判断, 氧化性强的阳离子首先在阴极得电子被还原。
阳离子得电子的能力:
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)> Pb2+>Sn2+>Fe2+> Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
2.电极判断: 阳极: 相连,发生 反应。
阴极: 相连,发生 反应。
1.定义 。
8.1mol氢气燃烧时约放热286kJ,而每千克汽油燃烧时约放热46000kJ。氢气被公认是21世纪替代矿物燃料的理想能源。试简述氢气作为能源的三个主要优点: 、 、
7.硝化甘油(C3H5N3O9)分解时产物为N2 、CO2 、O2和H2O(l),它的分解反应方程式为: 。 已知20℃时2.27g硝化甘油分解放出的热量为15.4kJ,则生成1mol气体伴随放出的热量为 kJ。
根据下列叙述回答4-6题
能源可划分为一级能源和二级能源。自然界中以现成形式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取:2H2O(液)=2H2(气)+O2(气);ΔH=+517.6kJ/mol
4.下列叙述正确的是 ( )
A.电能是二级能源 B.水力是二级能源
C.天然气是一级能源 D.焦炉气是一级能源
5.已知2H2(气)+O2(气)=2H2O(液);ΔH=-571.6kJ/mol 。CH4(气)+2O2(气)=2H2O(液)+CO2(气);ΔH=- 890.3kJ/mol 。1g氢气和1g甲烷分别燃烧后,放出热量之比最接近 ( )
A.1:3.4 B. 1:1.7 C.2.5:1 D.4.6:1
6.关于用水制取二级能源氢气,以下研究方法不正确的是 ( )
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解
的情况下,使氢成为二级能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊化学物质,用于开发廉价能源,以分解水制氢气
课外作业
1.已知:乙炔和乙烯燃烧的热化学方程式是
2C2H2(g)+5O2(g)== 4CO2(g)+2H2O(l);ΔH=-2600kJ/mol
C2H4(g)+3O2(g)==2CO2(g)+2H2O(l);ΔH=-1411kJ/mol
又已知,乙炔火焰的温度比乙烯火焰的温度高。据此,下列叙述错误的是 ( )
A.每摩尔烃完全燃烧时,放热多的,火焰温度也高
B.烃完全燃烧时,火焰温度高低不仅决定于燃烧的反应热大小
C.同条件等体积乙炔和乙稀完全燃烧,乙炔放的热稍小,耗氧少,产物的物质的量也少
D.每摩尔乙稀完全燃烧,生成气态产物时,放热小于1411kJ
2.在100g碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且
C(固)+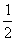 O2(气)=CO(气);ΔH=-110.35kJ/mol
O2(气)=CO(气);ΔH=-110.35kJ/mol
CO(气)+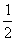 O2(气)+CO2(气);ΔH=-282.57kJ/mol
O2(气)+CO2(气);ΔH=-282.57kJ/mol
与这些碳完全燃烧相比,损失的热量是 ( )
A.392.92 kJ B.2489.44 kJ C.784.92 kJ D.3274.3 kJ
3.在同温同压下,下列各组热化学方程式中,Q2>Q1的是( )
A.2H2(气)+O2(气)=2H2O(气);ΔH=-Q1kJ/mol
2H2(气)+O2(气)=2H2O(液);ΔH=-Q2kJ/mol
B.S(气)+O2(气)=SO2(气);ΔH=-Q1kJ/mol
S(固)+O2(气)=SO2(气);ΔH=-Q2kJ/mol
C.C(固)+(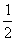 )O2(气)=CO(气);ΔH=-Q1kJ/mol
)O2(气)=CO(气);ΔH=-Q1kJ/mol
C(固)+O2(气)=CO2(气);ΔH=-Q2kJ/mol
D.H2(气)+Cl2(气)=2HCl(气);ΔH=-Q1kJ/mol
(1/2)H2(气)+(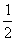 )Cl2(气)=HCl(气);ΔH=-Q2kJ/mol
)Cl2(气)=HCl(气);ΔH=-Q2kJ/mol
4.已知CH4(g)+2O2(g)
 CO2(g)+2H2O(l);ΔH=-Q1kJ/mol ,2H2(g)+O2(g)
CO2(g)+2H2O(l);ΔH=-Q1kJ/mol ,2H2(g)+O2(g)
 2H2O(g);ΔH=-Q2kJ/mol ,2H2(g)+O2(g)
2H2O(g);ΔH=-Q2kJ/mol ,2H2(g)+O2(g)
 2H2O(l);ΔH=-Q3kJ/mol ,室温时,取体积比为4∶1 的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的 热量为
( )
2H2O(l);ΔH=-Q3kJ/mol ,室温时,取体积比为4∶1 的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的 热量为
( )
A.0.4Q1+0.05Q3kJ B.0.4Q1+0.05Q2kJ
C.0.4Q1+0.1Q3kJ D.0.4Q1+0.2Q2kJ
5.已知298K时2SO2(g)+O2(g)==2SO3(g);ΔH=-197kJ/mol。在相同温度下,向密闭容器中通入2molSO2和1molO2达到平衡时放出热量Q1;向另一相同体积的密闭容器中通入1molSO2 和0.5molO2.达到平衡时放出热量Q2 ,则下列关系式正确的是 ( )
A.Q2=Q1/2 B.Q2<Q1/2 C.Q2<Q1<197kJ D.Q1=Q2<197kJ
6.“若是一个反应可以分几步进行,则各步反应的反应热总和与这个反应(在相同条件下)一次发生的反应热相同”,这就是有名的盖斯定律,参照回答。
已知白磷和红磷分别在氧气中完全燃烧的热化学方程式:
①P4(固、白磷)+5O2(气)=P4O10(固);ΔH=-2983.2kJ/mol

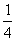
②P(固、红磷)+ O2(气)= P4O10(固);ΔH=-1738.5kJ/mol
则白磷转化为红磷的热化学方程式是 .由此热化学方程式看出,更稳定的磷的同素异形体是 。
3.酒精燃烧的化学方程式为C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l)。完全燃烧一定质量的无水洒精,放出的热量为Q。为了完全吸收生成的CO2 ,消耗50mL 8mol/L的NaOH溶液时恰好生成正盐。则燃烧1mol无水酒精所放出的热量为 ( )
A.0.2Q B.0.1Q C.5Q D.10Q
2.已知:CH4(气)+2O2(气)=CO2(气)+2H2O(液);ΔH=-Q1;2H2(气)+O2(气)=2H2O(气);ΔH=-Q2;2H2(气)+O2(气)=2H2O(液);ΔH=-Q3。常温下取体积比4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为
( )
A.0.4Q1+ 0.05Q3 B. 0.4 Q1+0.05Q2
C. 0.4 Q1+ 0.1Q3 D. 0.4 Q1+0.2Q2
1.已知下列两个热化学方程式:2H2(气)+O2(气)=2H2O(液);ΔH=-571.6kJ/mol;C3H8(气)+5O2(气)=3CO2(气)+4H2O(液);ΔH=-2220kJ/mol。实验测知氢气和丙烷的混合气体有5mol,完全燃烧时放热3847kJ,则混合气体中氢气与丙烷的体积比是 ( )
A.1:3 B.3:1 C.1:4 D.1:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com