
18.(6分)等质量的甲、乙、丙、丁、戊、己6种只含C、H、O三种元素的有机物,分别充分燃烧时,消耗等量的O2,且生成的气体全部分别通过足量的浓硫酸、碱石灰后,浓硫酸与碱石灰质量增重之比均为9∶22。已知:
① 6 M(甲)=3 M(乙)=3 M(丙)=3 M(丁)=2 M(戊)=M(己)=180;
② 乙、戊的水溶液可使甲基橙试液变红,相互之间在一定条件下能发生酯化反应;
③ 戊的核磁共振氢谱有4种峰,峰面积之比为3∶1∶1∶1;
④ 甲、丙、丁、己均能发生银镜反应。丙不易溶于水但丁易溶于水。
请回答下列问题:
(1)甲的结构简式为 ;己有多种同分异构体,其中一种存在于糖尿病患者的尿液中,写出其结构简式 。
(2)乙、丙、丁三者之间的关系是
 ;
;
丁的结构简式为 。
(3)写出2分子戊生成1分子环状酯的化学方程式 。
17.(8分)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 、 。
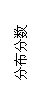

 (2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是
;发生反应的△H 0(填“>”、“<”或“=”)。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是
;发生反应的△H 0(填“>”、“<”或“=”)。

(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
(4)高铁酸钾还制作可充电电池,原理为:
 3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,
写出该电池充电时阳极电极反应式 。
0.1molCO生成,则10min内反应的平均速率V(H2)= 。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 。
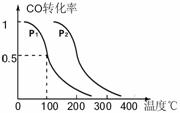 (3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g) +2H2(g)
(3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g) +2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
① P1 P2 (填“<”、“>”或“=")。
②在其它条件不变的情况下,反应室3再增加amolCO与2amolH2,达到新平衡时,
CO的转化率______(填“增大”、“减小”或“不变”。下同。),平衡常数 。
③在P1压强下,100℃时,CH3OH(g)  CO(g) + 2H2(g)反应的平衡常数为
CO(g) + 2H2(g)反应的平衡常数为
(用含a、V的代数式表示)。
16. (10分)二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
(10分)二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:


请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)
△H>0。
CO(g)+3H2(g)
△H>0。
在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或
“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有
15.(8分)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A 、D及C、F分别是同一主族元素。A、C两元素可形成原子个数之比为2:1、1:1型化合物。B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。F元素的最外层电子数是次外层电子数的0.75倍。请回答:
、D及C、F分别是同一主族元素。A、C两元素可形成原子个数之比为2:1、1:1型化合物。B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。F元素的最外层电子数是次外层电子数的0.75倍。请回答:
(1)由E、F两种元素组成的化合物1mol跟由A、C、D三种元素组成的化合物的溶液
 发生反应,消耗后者物质的量最大值为 mol。
发生反应,消耗后者物质的量最大值为 mol。
(2)A、C、F间形成的甲、乙两种微粒,甲有18个电子,乙有10个电子,它们均为负一价双原子阴离子,则甲与乙反应的离子方程式为 。
(3)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1molA2C和1molBC、2molA2C和2molBC。一定条件下,充分反应后分别达到平衡(两容器温度相同)。下列说法正确的是 。
A.达到平衡所需要的时间:Ⅰ>Ⅱ
B.达到平衡后A2C的 转化率:Ⅰ=Ⅱ
转化率:Ⅰ=Ⅱ
C.达到平衡后BC的物质的量:Ⅰ>Ⅱ D.达到平衡后A2的体积分数:Ⅰ<Ⅱ
E.达到平衡后吸 收或放出的热量:Ⅰ=Ⅱ
收或放出的热量:Ⅰ=Ⅱ
F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ
(4)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极 反应式是
。
反应式是
。
14.(12分)锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4 = ZnS↓+BaSO4↓。以下是工业生产流程。请回答有关问题:
Ⅰ.ZnSO4溶液的制备与提纯
有关资料:已知Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等。

(1)②中使用的氧化剂最好是下列的 (填序号),理由是 。
A.Cl2 B.H2O2 C.KMnO4 D.浓HNO3
(2)写出反应④的离子方程式: 。
(3)为了达到综合利用、节能减排的目的,上述流程中步骤 产生的 可以用于步
骤 (其中步骤选填①、②、③、④、⑤)。
Ⅱ.BaS溶液的制备
 有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = -1473.2 kJ•mol-1
有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = -1473.2 kJ•mol-1
C(s)+ -O2(g)=CO(g); △H = -110.5 kJ•mol-1
Ba(s)+ S(s)=BaS(s); △H = -460 kJ•mol-1

(4)煅烧还原的热化学方程式为: 。
(5)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示) 。
Ⅲ. 制取锌钡白
(6)Ⅰ中步骤⑤使用硫酸的量要适当,如果所得溶液的酸性过强,产生的后果是 。
12.化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是

A.根据图①可判断可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
第Ⅱ卷 选择题(共78分)
|
 1)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇。
1)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇。
|
 |
|||||
|
|||||
 |
|||||


|
实验药品:铜丝20 g、氯化铵20 g、65% 硝酸10 mL、36%盐酸15 mL、水。
(1)反应①的化学方程式为 ,
用95%乙醇代替蒸馏水洗涤的主要目的是 。
(2)工业化生产时,95%乙醇可通过______方法回收并循环利用,而NH4Cl、_________(填化学式)可直接循环利用。
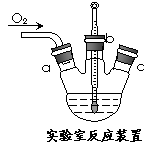
(3)实验室用右上图装置制备CuC1。
①实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,最宜选择 装置(填字母序号A、B、C)。



②实验开始时,温度计显示反应液温度低于室温,主要原因是
; 电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色,从环保角度考虑,当
_时才能停止通入氧气,待冷却至室温后,再打开瓶塞,沿_______(填字母a、b、c)口倾出棕色反应液于1000 mL大烧杯中,加水500 mL,即刻有大量白色沉淀析出。
电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色,从环保角度考虑,当
_时才能停止通入氧气,待冷却至室温后,再打开瓶塞,沿_______(填字母a、b、c)口倾出棕色反应液于1000 mL大烧杯中,加水500 mL,即刻有大量白色沉淀析出。
11.利用下图所示的有机物X可生产S-诱抗素Y。下列说法正确的是
|
|



A.X结构中有2个手性碳原子
B.X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐。
C.Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
D.1 molX与足量NaOH溶液反应,最多消耗5 mol NaOH, 1 molY最多能加成4 molH2。
1 molY最多能加成4 molH2。
10.将几滴KSCN(SCN-是“类卤离子”)溶液加入到含有Fe 3+的酸性溶液中,溶液变成红
3+的酸性溶液中,溶液变成红
色。将该红色溶液分为两份:①一份中加入适量KMnO4溶液,红色褪去;②向另一份中
通入SO2,红色也褪去。下列推测肯定不正确的是
A.①中红色褪去的原因是KMnO4将SCN-氧化
B.②中红色褪去的原因是SO2将Fe3+还原为Fe2+
C.②中红色褪去的原因是SO2将SCN-还原
D.SCN-在适当条件下可失去电子被氧化为(SCN)2
9.下列溶液中有关物质的量浓度关系正确的是
A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:
c (Na+) >c (CH3COO-)>c(H+)>c(OH-)
B.向NH4HSO4溶液中滴加等物质的量的NaOH形成的溶液中:
c(Na+) = c(SO42-) >c(NH4+) >c(H+) >c(OH-)
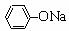 C.NaHCO3溶液中:c(OH-)- c(H+)=c(H2CO3) - c(CO32-)
C.NaHCO3溶液中:c(OH-)- c(H+)=c(H2CO3) - c(CO32-)
D.在浓度均为0.1 mol·L-1Na2CO3、NaHCO3、 、NH4Cl溶液中c(H+)分别为c1、c2、c3、c4,则c4>c3>c2>c1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com