
4. 在一固定容积的密闭容器中进行下列反应:
A(气) + B(气)  2C(气) 已知加入1molA和2molB时,达平衡时生成a molC,保持温度等其它条件不变,要求达平衡时各物质的百分含量不变,请填写下表中(1)(2)(3)中的空格。
2C(气) 已知加入1molA和2molB时,达平衡时生成a molC,保持温度等其它条件不变,要求达平衡时各物质的百分含量不变,请填写下表中(1)(2)(3)中的空格。
起始状态时各物质的物质的量/mol 平衡状态时C的物质的量mol-1

 A
B C
A
B C
已知: 1 2 0 a
(1) 2 4 0 2a
(2) 1 0.5a
(3) m n(n≥2m)
3. 一定条件下A2、B2、C的起始浓度分别为a、b、c mol·l-1可逆反应
A2(g) + B2(g)  2C(g)达平衡状态,测得[A2]=0.5 mol·L-1[B2]= 0.1
mol·L-1,[C]= 1.6 mol·L-1
2C(g)达平衡状态,测得[A2]=0.5 mol·L-1[B2]= 0.1
mol·L-1,[C]= 1.6 mol·L-1
问:(1)a、b应满足的条件是_________
(2)a的取值范围是_________,理由是_________。
2. 近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,其反应的化学方程式为:
NH3 + HClO H2O + NH2Cl(一氯氨)
H2O + NH2Cl(一氯氨)
NH2Cl较HClO稳定,试分析液氨能延长液氯杀菌时间的原因:____________ ___________________________________________________
5. 在一个6L的密闭容器内,放入3LX(气)和2LY(气),在一定条件下发生下列反应:4X
(气) + 3Y(气)  2Q(气) + nR(气)达平衡后,容器内温度不变,混和气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值是( )
2Q(气) + nR(气)达平衡后,容器内温度不变,混和气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值是( )
A. 3 B. 4 C. 5 D. 6
课外作业
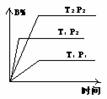 1. 已知某可逆反应mA(g) + n B(g)
1. 已知某可逆反应mA(g) + n B(g)  pC(g) + Q在密闭容器中进行,图中表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析下列判断正确的( )
pC(g) + Q在密闭容器中进行,图中表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析下列判断正确的( )
A. T1 < T2 P1 > P2 m + n >P Q < 0
B. T1 > T2 P1 < P2 m + n >P Q < 0
C. T1 < T2 P1 > P2 m + n <P Q > 0
D. T1 > T2 P1 < P2 m + n <P Q < 0
4. 下列事实中不能利用勒沙特列原理来解释的( )
A. 往硫化氢水溶液中加碱有利于S2-的增多
B. 加入催化剂有利于氨氧化的反应
C. 高压有利于合成氨的反应
D. 500℃左右比室温更有利于氨的合成
3. 将固体NH4I置于密闭容器中,在某温度下发生下列反应:
NH4I(固)  NH3(气) + HI(气)
NH3(气) + HI(气)
2HI(气)  H2(气) + I2(气)
H2(气) + I2(气)
当反应达平衡时,[H2]= 0.5 mol·L-1[HI]= 4 mol·L-1则NH3的浓度为( )
A. 3.5 mol·L-1 B. 4 mol·L-1 C. 4.5 mol·L-1 D. 5 mol·L-1
2. 在一固定体积的密闭容器中,加入2 mol A和1 mol B,发生反应:
2A(气) +B(气)  3C(气)+D(气) 达平衡时,C的浓度为Wmol·L-1,若维持容器体积和温度不变,按下列四种配比做起始物质,达平衡后,C的浓度仍为Wmol·L-1的是( )
3C(气)+D(气) 达平衡时,C的浓度为Wmol·L-1,若维持容器体积和温度不变,按下列四种配比做起始物质,达平衡后,C的浓度仍为Wmol·L-1的是( )
A. 4molA + 2 molB
B. 2molA + 1molB + 3molC + 1molD
 C. 3molC + 1molD + 1molB
C. 3molC + 1molD + 1molB
D. 3molC + 1molD
1. 在一定温度下,反应A2(气) +B2(气)  2AB(气)达到平衡的标志是( )
2AB(气)达到平衡的标志是( )
A. 单位时间内生成n mol的A2同时生成n mol的AB
B. 容器内总压不随时间变化
C. 单位时间内生成2n mol AB同时生成n mol B2
D. 单位时间生成n molA2的同时生成n mol的B2
3.工业流程
原料气的制取 → 净化 → 压缩 → 合成 → 分离 → 液氨
[例题解析]
[例1]在673k,1.01×105帕的条件下,有1摩某气体A发生如下反应:2A(气)  xB(气)+ C(气),在一定条件下已达平衡,在平衡混合气中,A在混合气中的体积百分比为58.84%,混合气的总质量为46克,密度为0.72g·L‐1,求:
xB(气)+ C(气),在一定条件下已达平衡,在平衡混合气中,A在混合气中的体积百分比为58.84%,混合气的总质量为46克,密度为0.72g·L‐1,求:
(1)达平衡后,混合气的平均分子量
(2)A的平衡转化率
(3)x = ?
 (4)相同条件下,反应前A气体的密度是平衡混合气密度的几倍?
(4)相同条件下,反应前A气体的密度是平衡混合气密度的几倍?
解题思路: 。
易错点: 。
[例2.] 将2mol SO2 和 2mol SO3气体混和于某固定体积的密闭容器中,在一定条件下反应。 2SO2(气) + O2(气)  2SO3(气) 平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的容器中反应,反应达平衡时,SO3的物质的量大于n mol的是( )
2SO3(气) 平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的容器中反应,反应达平衡时,SO3的物质的量大于n mol的是( )
A . 2 mol SO2 + 1 mol O2 B. 4 mol SO2 + 1 mol O2
C . 2 mol SO2 + 1 mol O2 + 2 mol SO3
D 3 mol SO2 + 1 mol O2 + 1 mol SO3
解题思路: 。
易错点: 。
[考题再现]
在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应,各物质的起始加入量如下:A、B和C均分别为4.0mol,D为6.5mol,F为2.0mol,设E为Xmol,当X在一定范围内变化时,均可通过调节反应器的温度,使两侧反应都达平衡,并使隔板恰好处于反应器的正中位置请填写以下空白:
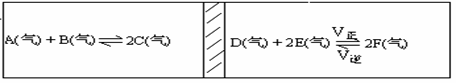
(1)若X = 4.5,则右侧反应在起始时向__________(填:“正反应”或“逆反应”)方向移动,欲使起始反应维持向该方向进行,则X的最大取值应小于___________。
(2)若X分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?_____________(填:“相等”、“不相等”或“不能确定”)。理由是__________。
思维方法: 。
展望高考:
[巩固练习]
课堂反馈
2.合成氨工业简述
(1).原料气的制备 净化和压缩
①N2来源于空气:方法一 ;方法二
.
②H2来源于 ;相关的化学方程式是
除去杂质的混合气体用压缩机压缩至高压,送入合成塔.
(2)氨的合成:
(3)氨的分离:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com