
11.(18分)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
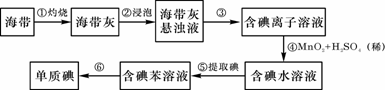
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)由海带灰获取Iˉ溶液的具体操作是____________________________________
___________________________________________________________。
(3)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(4)步骤④反应的离子方程式是 。
此步操作还可以加入更合适的试剂是_________(从下面选择填代号);理由是___
____________________________________________________________________。
A、浓硫酸 B、新制氯水 C、酸化KMnO4溶液 D、酸化H2O2
(5)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
。
10.(18分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
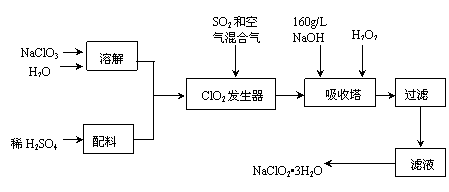
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
(a)将SO2氧化成SO3,增强酸性; (b)稀释ClO2以防止爆炸; (c)将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
(a) Na2O2 (b) Na2S (c)FeCl2 (d)PbO(悬浊液)
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)。
9.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体不是纯净物的是
A.向Fe、FeO和Fe2O3的混合物中加入过量的盐酸
B.等物质的量浓度、等体积的(NH4)2SO4与 BaC12溶液
C.等物质的量的 NaHCO3与 Na2O2固体
D.在NaBr、NaI混合溶液中通入过量氯气
8.碘是卤素中原子半径较大的元素,有时可呈现金属性。下列事实能说明该结论的是
A.HIO在水溶液中存在电离平衡:HIO I++OH-
I++OH-
B.I(NO3)3晶体中含有I 3+离子
C.化合物HIO4具有酸性
D.IBr、ICl等卤素互化物为共价化合物
7.粗碘中通常含ICl和IBr,称为卤素互化物,其性质和卤素相似,都是较强的氧化剂,而且受热时ICl和IBr皆可象I2一样升华。在粗碘中加入下选项中一种物质后,再进行升华可制得精碘,应加入的物质是
A.H2O B.Zn C.KI D. KCl
6.氟气是氧化性最强的非金属单质。在加热条件下,等物质的量氟气与烧碱完全反应,生成NaF、H2O和另一种气体,该气体可能是
A.H2 B.HF C.O2 D.OF2
5.某无色溶液中,若加入NaClO溶液或适量HCl溶液,均能产生淡黄色沉淀。则原溶液中可能大量存在的离子组是
A.Na+、K+、S2–、Cl– B.H+、Na+、S2–、NO3–
C.K+、Ca2+、S2–、SO32– D.Na+、S2–、SO32–、SO42–
4.
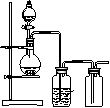 可用如图装置制取(必要时可加热)、净化、收集的气体是
可用如图装置制取(必要时可加热)、净化、收集的气体是
A.铜和稀硝酸制一氧化氮
B.氯化钠与浓硫酸制氯化氢
C.锌和稀硫酸制氢气
D.硫化亚铁与稀硫酸制硫化氢
3.在①干燥的氯气、②浓盐酸、③活性炭、④漂白粉、⑤双氧水、⑥二氧化硫等六种物质中,能使品红溶液褪色的是
A.①④⑥ B.②③④ C.①③④⑥ D.①③④⑤⑥
2.下列物质露置于空气中易变质的是①氯水 ②水玻璃 ③烧碱 ④漂白粉 ⑤绿矾 ⑥亚硫酸钠
A.除⑤外 B.除②③外 C.除②③⑥外 D.全易变质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com