
6.朱德在一首诗中写道:“辛亥革命已十年,清朝余孽继当权。列强勾结诸军阀,掠夺人民更不堪。”这段材料从本质上说明了
A.资产阶级共和国的道路在中国行不通
B.民族资产阶级不能领导中国革命取得胜利
C.不推翻列强就不能从根本上消除中国动乱的根源
D.中国半殖民地半封建社会的性质并未根本改变
5.《天朝田亩制度》中规定生产者“除足其二十五家每人所食可接新谷外,余则归国库”,由国家统一支配,甚至连鸡狗等禽畜也不例外。这实质上表明太平天国
A.试图保持社会的公正无差 B.实行绝对平均主义
C.安排一切经济和社会生产活动 D.彻底消灭人们的私有观念
4.钱穆在《国史新论》中写道“自经此项制度推行日久,平民社会,穷苦子弟,栖身僧寺,十年寒窗,也可跃登上第。”材料中所说的这项制度指的是
A.世官制 B.察举制 C.九品中正制 D.科举制
3.杜牧《上李太尉论江贼书》记载“(江贼)水劫不便,逢遇草市,泊舟津口,便行陆劫。
……凡江淮草市,尽近水际,富室大户,多居其间。自十五年来,江南江北,凡名草市,劫杀皆便,只有三年再劫者,无有五年获安者。”从上述材料中可以提取的信息有
①民间集市在江淮出现 ②古代经济重心开始南移
③草市税是国家重要收入 ④交易者财货缺乏安全保障
A.①② B. ③④ C.①④ D.②③
2.汉高祖刘邦想废太子(吕后所生长子,即汉惠帝刘盈)而立戚姬之子如意为新太子。御史大夫周昌说:“臣口不能言,然臣期期知其不可。陛下欲废太子,臣期期不奉诏”。周昌极力反对汉高祖废太子的原因是
A.确立皇帝至高无上的威权 B.坚守御史大夫谏议之责
C.维护传统宗法继承制度 D.根除影响汉政权稳定的隐患
1.以下是著名学者对春秋战国时期“诸子百家”及其学说的评价,其中属于评价老子及其道家学说的是
A.崇功利,尚干涉,巩固君权,抑制民权。(苏渊雷)
B.人对自然只能任(顺从) 和法(效法),不能违背它。(范文澜)
C.同情公室,反对私门,一味开倒车。(郭沫若)
D.其思想深信政府万能,而不承认人类个性之神圣。(梁启超)
20.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题作答。若两题都做,则按A题评分。
A.CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如S02、SnCl2等还原制得:
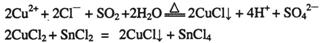
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
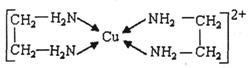
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_________。H、N、O三种元素的电负性由大到小的顺序是_____。
(2)SO2分子的空间构型为____________。与SnCl4互为等电子体的一种离子的化学式为_________。
(3)乙二胺分子中氮原子轨道的杂化类型为_____________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_____________________________________________。
 (4)②中所形成的配离子中含有的化学键类型有__________。(填字母)
(4)②中所形成的配离子中含有的化学键类型有__________。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
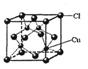
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_________。
B.阿司匹林(乙酰水杨酸)是常用的解热镇痛药,以下是合成阿司匹林的工艺流程。
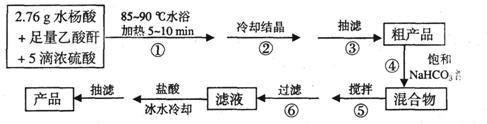
已知:①反应方程式为
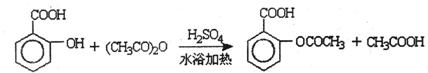
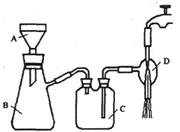
②抽滤的实验装置如右图所示。
请回答有关问题:
(1)仪器A的名称是_____________。
(2)在步骤②中,若冷却结晶时未出现结晶,可以___________,
促使晶体析出。
(3)实验时,当仪器B中液面高度快达到支管口位置时,应进行
的操作是____________________________________________。
(4)仪器C中两玻璃导管的位置是否正确?答:_________。(填“正确”或“不正确”)
(5)在步骤④中,用饱和NaHC03溶液可以将阿司匹林和剐产物等分离,其化学原理是
_________________________________________。要检测产品中是否含有水杨酸,其实验操作是_____________________________________________________。
(6)在步骤⑤中,搅拌使反应充分进行至_____________为止。
(7)若实验得到2.70g纯净的阿司匹林,则产品的产率为____________。
19.(10分)草酸(H2C204)是一种重要的化工原料。已知常温下0.01 mol·L-l的H2C204、KHC204、K2C204溶液的pH如下表所示。 。.
|
|
H2C204 |
KHC204 |
K2C204 |
|
pH |
2.0 |
3.1 |
8.1
、 |
(1)在其它条件不变时,下列措施能使KHC204溶液中c(K+):c(HC204-)接近1:1的是_________(填字母)。
A.加入适量的H2C204 B.加入适量的KHC204
C.加入适量的Na2C204 D.升高溶液的温度
(2)取一定质量H2C204·2H20和KHC204的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-l NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-l H2S04溶液酸化后,用0.10 mol·L-l KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
①完成离子方程式:5C2042-+2Mn04-+16H+ =10______+2Mn2++8H2O。
②原混合物中H2C204·2H20和KHC204的物质的量之比为__________。
(3)某实验小组用如图所示的装置探究FeC204·2H20在隔绝空气条件下受热分解的产物。当36.0g FeC204·2H20充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g。求残留固体的成分和物质的量。(已知FeC204·2H20的相对分子质量为180;设反应产生的气体被充分吸收)
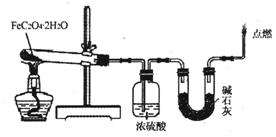
18.(12分)聚-3-羟基丁酸酯(PHB)可用于制造可降解塑料等。PHB是由许多3-羟基丁酸分子聚合而成,合成聚-3-羟基丁酸酯的途径有很多,其中一种途径的副产品少、污染小、原子利用率高,其合成路线如下:
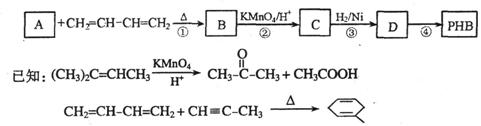
请回答下列问题:
(1)写出C中含有的官能团的名称:__________________。
(2)上述转化过程中属于加成反应的是________________(填序号)。
(3)反应②符合绿色化学思想(碳原子的有效利用率为100%),则A的结构简式为
_________________________。
(4)写出与C互为同分异构体,能发生银镜反应,且核磁共振氢谱有两个吸收峰的有机物的结构简式:_____________________________。
(5)反应④的化学方程式为_____________________________________________________。
(6)4-羟基丁酸钠(HOCH2CH2CH2COONa)是一种麻醉药。现以上述合成路线中的C物质为原料制取4-羟基丁酸钠,请写出其合成路线流程图(合成过程中无机试剂任选,并注明反应条件)。
提示:由乙醇制取聚乙烯的合成路线流程图可表示为:
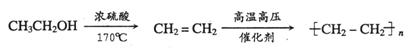
17.(10分)随着工业的迅速发展,产生的废水对水体的污染也日趋严重。通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的方法。下表是常温下金属氢氧化物的Ksp(沉淀溶解平衡常数)和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度;当溶液中金属离子浓度小于10-5 mol·L-1时通常认为该离子沉淀完全)。
|
金属离子 |
Ksp |
pH(10-1mol·L-l) |
pH(10-5mol·L-l) |
|
Fe3+ |
4.0×10-38 |
2.7 |
3.7 |
|
Cr3+ |
6.0×10-31 |
4.3 |
5.6 |
|
Cu2+ |
2.2×10-20 |
4.7 |
6.7 |
|
Ca2+ |
4.0×10-5 |
12.3 |
14.3 |
(1)某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1 mol·L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是_______________________________。
(2)为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加人适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。
①Cr2O72-转变为Cr3+的离子方程式为_______________________________。
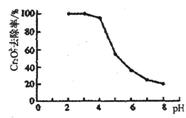 ②pH对废水中Cr2072-去除率的影响如右图。你认为电解过程中溶液的pH取值在______范围内对降低废水中的铬含量最有利,请说明理由:____________________________________________。
②pH对废水中Cr2072-去除率的影响如右图。你认为电解过程中溶液的pH取值在______范围内对降低废水中的铬含量最有利,请说明理由:____________________________________________。
[注:去除率(%)=[(c0-c)/co]×100%,
式中:co-理前废水中Cr2O72-的浓度,
c-处理后废水中Cr2O72-的浓度]
(3)沉淀转化在生产中也有重要应用。例如,用Na2C03溶液可
以将锅炉水垢中的CaS04转化为较疏松而易清除的CaC03,该沉淀转化达到平衡时,其平衡常数K=_________(写数值)。[已知Ksp (CaS04)=9.1x10-6,Ksp (CaC03)=2.8x10-9]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com