
2.若以W1和W2分别表示浓度为amol/L和bmol/L氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小) ( )
A. 2W1=W2 B. 2W2=W1 C. W2>2W1 D.W1<W2<2W1
思维方法: 。
展望高考:
[巩固练习]
课堂反馈
1.(03江苏高考题)同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是 (1)NO和NO2, (2)NO2和O2 (3)NH3和N2。现将3支试管均倒置于水槽中,充分反应后, 试管中剩余气体的体积分别为V1、V2、V3, 则下列关系正确的是 ( )
:A.V1>V2>V3 B.V1.>V3>V2 C.V2>V3>V1 D.V3>V1>V2
思维方法: 。
展望高考
4. NH4+ 鉴别的常用试剂: 有关的离子方程式 。
[例题解析]
[例1] 在标准状况下,在三个干燥的烧瓶内分别装入干燥纯净的NH3、含一半空气的氯化氢气体、NO2和O2的混合气体( V NO2/V O2 = 4:1)。然后分别作喷泉实验, 三个烧瓶中所得溶液的物质的量浓度之比为 ( )
A. 2:1:2 B. 5:5:4
C.1:1:1 D.无法确定
解题思路: 。
易错点: 。
[例2] 氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是 ( ).
A.NH4H是离子化合物,固态时属离子晶体
B. NH4H溶与水,所形成的溶液显酸性
C. NH4H固体投入少量的水中,有两种气体产生
D. NH4H与水反应时, NH4H是氧化剂
解题思路: 。
易错点: 。
[考题再现]
3.所有的铵盐和碱反应加热都生成NH3 。
2. 铵盐受热都发生分解,不同物质、不同温度、分解产物有所不同。
1. 铵盐常温下都是 体, 溶与水,均为 化合物。
9.将amol H2S和1mol O2置于一个容积可变的容器内进行反应。维持容器内气体的压强不变(101KPa),在120℃下测得反应前后容器内气体的密度分别为d1和d2。若a的取值不同,则H2S的氧化产物可能有如下三种情况:
(1)全部是SO2此时a的取值范围是 。
(2)全部是S,此时a的取值范围是 ,并且d1 d2(填“小于”、“大于”或“等于”)。
(3)部分是SO2,部分是S,此时a的取值范围是 。反应所生成SO2的物质的量为 mol。容器内气体的物质的量之和为 mol(以含a的代数式表示)。
8.有一瓶亚硫酸钠溶液已部分氧化变质:2Na2SO3+O2 2Na2SO4,某学生设计了下列实验,确定Na2SO3的纯度:
2Na2SO4,某学生设计了下列实验,确定Na2SO3的纯度:
①称取ag样品。称量时所用主要仪器的名称是
②样品的溶解。溶解过程中使用玻璃棒搅拌的目的
③在溶液中加入过量的BaCl2溶液且用盐酸酸化。
(1)为什么要用盐酸酸化?
(2)BaCl2为什么要过量?
(3)怎样检验BaCl2溶液是否过量?
(4)为什么要洗涤沉淀?
(5)怎样洗涤沉淀?
(6)怎样判断沉淀是否洗净?
(7)烘干沉淀并计算。烘干后称量沉淀质量为bg,列出计算Na2SO3纯度的计算式。
5.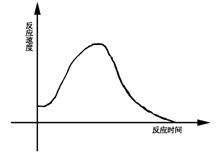 氯酸钾和亚硫酸氢钠间氧化还原反应生成Cl-和S+6的速度,如右图所示,又已知这个反应的速度随着溶液中氢离子浓度增大而加快。
氯酸钾和亚硫酸氢钠间氧化还原反应生成Cl-和S+6的速度,如右图所示,又已知这个反应的速度随着溶液中氢离子浓度增大而加快。
(1)为什么反应开始时反应速度加快?
(2)为什么后期反应速度下降?
3.亚硫酸钠中有+4价的硫,它既有氧化性又有还原性。现有试剂:溴水、硫化钠溶液、亚 硫酸钠溶液、稀硫酸、烧碱溶液、氨水。
①要证明Na2SO3具有还原性,应选用的试剂有 ,看到的现象 ,反应的离子方程式为 。
②要证明Na2SO3具有氧化性,应选用的试剂有 、 看到的现象 ,反应的离子方程 式为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com