
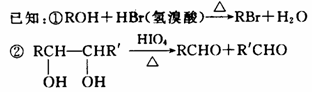
12.(19分)奶油中含有一种用做香料的有机化合物A,该有机化合物只含有C、H、O三种元素,分子中C、H、O原子个数比为2:4:1,其相对分子质量为88,A的结构式中含有碳氧双键。1molB可生成2molC,也可与2mol 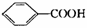 反应。
反应。
与A相关的反应如下:
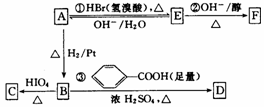
(1)写出反应②的反应类型:_____________________________。
(2)写出A、C、F的结构简式:A_____________________,C_______________,F_____________________。请写出两种与A的物质类别不同的同分异构体的结构简式:________________,________________。
(3)写出反应③的化学方程式:_____________________________________
(4)在空气中长时间搅拌奶油,A可转化为相对分子质量为86的化合物G,G的一氯代物只有一种,写出G的结构简式:____________________________。
答案及解析
11.(19分)某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题: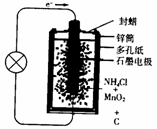
(1)如图是干电池的基本构造图,干电池工作时正极上的反应是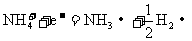 则负极上的电极反应式是________________。MnO2的作用是除去正极上的某产物,本身生成Mn2O3,该反应的化学方程式是
则负极上的电极反应式是________________。MnO2的作用是除去正极上的某产物,本身生成Mn2O3,该反应的化学方程式是
________________________________。
(2)锌皮和碳棒的回收:用钳子和剪子剪开回收的干电池的锌筒,将锌皮和碳棒取出,刷洗干净,将电池内的黑色粉末移入小烧杯中。
(3)氯化铵、氯化锌的提取、分离和检验。
①如何从黑色粉末中提取NH4Cl和ZnCl2的晶体混合物?写出简要的实验步骤:
____________________ ____。
②用什么方法可将NH4Cl和ZnCl2的晶体混合物分离开?
________________________________ ______.
③写出证明ZnCl2晶体中含Zn2+的操作步骤及实验现象:___________________
_______________________(已知Zn(OH)2是两性氢氧化物且能溶解于氨水)
④最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等,可用灼烧的方法除去杂质。该实验中需要用到的主要仪器除酒精灯外,还有__________________________________。
10.(10分)下面的框图是中学化学中几种常见物质的转化关系(其中部分产物已略去)。已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做制冷剂。 w.w.w.k.s.5.u.c.o.
w.w.w.k.s.5.u.c.o.
(1)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式_____________________________________。
(2)写出鉴定G中阳离子的离子方程式:_____________________。
(3)工业上电解B溶液制得一系列化工原料,写出其电解的化学方程式,并标出电子转移的方向和数目________________________________________。
(4)③的反应可以用来检验D储运时是否泄露,检验的现象是______________,该反应的化学方程式:________________________________。
9.(12分)硼酸晶体呈片状,有滑腻感,可做润滑剂。硼酸对人体的受伤组织有缓和和防腐作用,故可以用于医药和食品防腐等方面。试回答下列问题:
(1)从题目信息可知硼酸应属于___________酸(填“弱”或“强”)
(2)硼酸的分子式为H3BO3,已知H与O成键,则其分子结构式为:__________。
(3)研究表明:在大多数情况下,元素的原子在形成分子或离子时,其最外层有达到8电子稳定结构的趋向。已知0.01mol硼酸可以被20mL 0.5mol·L-1NaOH溶液恰好完全中和,据此推测硼酸在水溶液中呈酸性的原因是(用离子方程式表示)___________________________;写出硼酸与NaOH溶液反应的离子方程式:____________________________________________。
(4)硼酸和甲醇在浓硫酸存在的条件下,可生成挥发性硼酸酯,试写出硼酸完全酯化的方程式:_______________________________________。
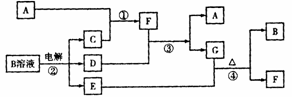
(5)科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。
上图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据下图确定硼化镁的化学式为____________________________________________。
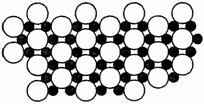
8.以下实验装置一般用于分离互溶的液体物质的是( )
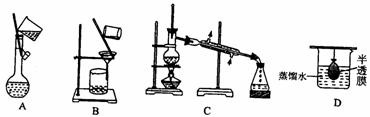
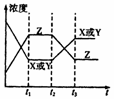
7. 如右图所示,对于反应:X(g)+Y(g) 2Z(g); △H<0,如果反应开始经t1秒后达平衡,又经t2秒后,由于条件改变,原平衡破坏,到t3秒时又建立新的平衡,则t2到t3曲线变化的原因是( )
如右图所示,对于反应:X(g)+Y(g) 2Z(g); △H<0,如果反应开始经t1秒后达平衡,又经t2秒后,由于条件改变,原平衡破坏,到t3秒时又建立新的平衡,则t2到t3曲线变化的原因是( )
A.增大了X或Y的浓度 B.使用了催化剂
C.增大了体系压强 D.升高了该反应的温度
6.关于阿伏加德罗常数(用NA表示)的下列叙述完全正确的是( )
A.在标准状况下,密闭容器中11.2L NO与11.2LO2混合后气体分子数为0.75NA
B.由3个碳原子形成的有机化合物,1mol该物质最多含有的C-C单键数为2NA
C.在铜锌硫酸原电池中,当Cu极生成0.2gH2,则电路通过电子数为0.2NA
 D.标准状况下,22.4L水中含分子数为NA
D.标准状况下,22.4L水中含分子数为NA
5.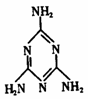 新华网北京2008年9月11日电:中国卫生部11日晚指出,近期甘肃等地报告多例婴幼儿泌尿系统结石病例,调查发现患儿多有食用某种品牌婴幼儿配方奶粉的经历,经相关部门调查得出该婴幼儿配方奶粉被三聚氰胺污染。三聚氰胺的结构式如右图:下列关于三聚氰胺的叙述正确的是(
)
新华网北京2008年9月11日电:中国卫生部11日晚指出,近期甘肃等地报告多例婴幼儿泌尿系统结石病例,调查发现患儿多有食用某种品牌婴幼儿配方奶粉的经历,经相关部门调查得出该婴幼儿配方奶粉被三聚氰胺污染。三聚氰胺的结构式如右图:下列关于三聚氰胺的叙述正确的是(
)
A.三聚氰胺分子中含有1个苯环、3个氨基
B.三聚氰胺属于氨基酸
C.三聚氰胺含氮量高达66.7%,有“假蛋白”之称,常被不法分子掺假在食品中
D.三聚氰胺与三聚氰酸[C3N3(OH)3]是同分异构体
4.某化学课外活动小组甲同学欲制备收集A气体,乙同学欲制备收集B气体(制备方法、装置、试剂的化学式均相同)。甲采用排水法收集到B气体,乙用排空气法却得到A气体。下列关于A、B两种气体的叙述不正确的是( )
A.A、B都是极性分子
B.A、B气体分子中均含有极性键
C.A为酸酐,B则不属于酸酐
D.A、B气体相对分子质量之差为16
3.下列说法正确的是( )
A.ⅠA族元素的金属性一定比ⅡA族元素的金属性强
B.ⅥA族元素中氢化物最稳定的其沸点一定最高
C.非金属元素形成的化合物中只有共价化合物
D.短周期中,同周期元素的离子半径从左到右逐渐减少
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com